
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1)E中官能团的名称是_________。
(2)B+D→F的化学方程式_________。
(3)X的结构简式_________。
(4)对于化合物X,下列说法正确的是_________。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是_________。
A.![]() B.
B.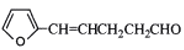
C.![]() D.
D.![]()
【答案】醛基 CH3COOH+![]()
![]()
![]() +H2O
+H2O ![]() AC BC
AC BC
【解析】
A为乙烯与H2O的加成产物,故A为CH3CH2OH(乙醇);A催化氧化得到B,根据B的分子式可知B为CH3COOH(乙酸)。甲苯光照条件下与氯气反应,则甲基氢原子被氢原子取代,故C为C6H5CH2Cl;C为卤代烃,在NaOH水溶液中水解生成醇,所以D为C6H5CH2OH(苯甲醇);D催化氧化为E,所以E为C6H5CHO(苯甲醛)。B(乙酸)和D(苯甲醇)发生酯化反应生成F(乙酸苯甲酯),乙酸苯甲酯和E(苯甲醛)发生已知的第二个反应生成X(![]() )。
)。
(1)E为苯甲醛,含有官能团为醛基。
(2)B为乙醇,D为苯甲醇,二者发生酯化反应生成酯F,化学方程式为:CH3COOH+![]()
![]()
![]() +H2O。
+H2O。
(3)类比已知条件RCHO+CH3COOR’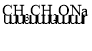 RCH=CHCOOR’可知,醛E和酯F也可发生同类反应得一种不饱和酯X,所以X的结构简式为:
RCH=CHCOOR’可知,醛E和酯F也可发生同类反应得一种不饱和酯X,所以X的结构简式为:![]() 。
。
(4)从X的结构看,X含有碳碳双键、酯基和苯环结构,酯基可以发生水解反应,苯环上的氢原子可以与浓硝酸发生取代反应,碳碳双键可以使溴的四氯化碳溶液褪色,但X中没有醛基,不能发生银镜反应,故选AC。
(5)F的结构为![]() ,与F互为同分异构体的是B、C两种物质,A、D均与F分子式不相同,均比F多一个亚甲基CH2原子团。
,与F互为同分异构体的是B、C两种物质,A、D均与F分子式不相同,均比F多一个亚甲基CH2原子团。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下,重水( D2O)的离子积常数为1.6×10-15,若用定义pH一样规定pD= -lgc(D+),则在该温度下,下列叙述正确的是
A. 纯净的重水中,c(D+) ·c(OD-)>1.0×10-14
B. l L溶解有0.01 mol DCl的重水溶液,其pD=2
C. 1 L溶解有0. 01 mol NaOD的重水溶液,其pD=12
D. 纯净的重水中,pD=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法是目前“海水提溴”使用到的主要方法之一。其工艺流程如下:
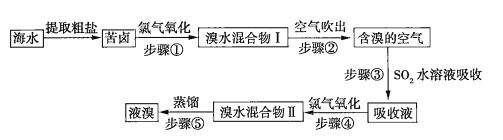
(1)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过___________(填化合物名称)溶液,以除去氯气。
(2)步骤⑤的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因_____________。
(3)步骤①中用硫酸酸化可提高![]() 的利用率,理由是__________。
的利用率,理由是__________。
(4)提取溴单质时,蒸馏溴水混合物Ⅱ而不是蒸馏溴水混合物Ⅰ,请说明原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 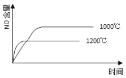
B. 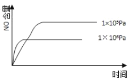
C. 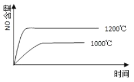
D. 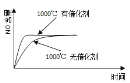
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有NO2、NO和CO等有害气体,现取标准状况下22.4 L汽车尾气,研究发现该气体通过催化转化器后,上述三种有害气体可被完全转化为无害的N2和CO2,再取等体积尾气通入0.1 mol/L 50 mL NaOH溶液中,其中的NO2和NO恰好被完全吸收。则尾气中CO的体积分数可能为(说明:汽车尾气中其它成分气体与CO和NaOH溶液均不反应)( )
A. 0.4% B. 0.8% C. 2% D. 4%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是______.
A.使用冷凝管时,应使冷却液与被冷却的物质流动方向相同;
B.盛过苯酚的试管可以用NaOH溶液清洗,若皮肤上沾有苯酚,应立即用酒精洗涤;
C.用![]() 的硫酸和无水乙醇加热至
的硫酸和无水乙醇加热至![]() ,可以制取乙烯;
,可以制取乙烯;
D.除去苯中的少量苯酚,可加入适量的浓溴水后再过滤;
E.分馏原油实验中,温度计的下端不插入原油中;
F.碳化钙是块状固体,但实验室中不用启普发生器制乙炔;
G.将苯与溴水混合后加铁屑可制取溴苯;
H.将溴乙烷与NaOH溶液共热几分钟后冷却,滴入![]() 溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在.
溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.12g金刚石中含有的共价键数为4NA
B.7g超重甲基(—CT3)中含有的电子数为3NA
C.标准状况下,22.4L氩气中含有的原子数约为2NA
D.0.1molNa2O2与SO2完全反应转的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
A.加催化剂B.升高温度C.充入CO2D.降低压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com