
【题目】汉黄芩素对肿瘤细胞的杀伤有独特作用,其结构如图所示,下列有关叙述正确的是( )
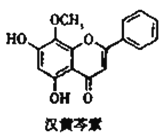
A. 汉黄芩素的分子式为C16H14O5
B. 1mol该物质与NaOH溶液反应,可消耗2molNaOH
C. 1mol该物质与溴水反应,最多消耗1molBr2
D. 该物质可发生取代、加成、缩聚、消去反应
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素,如图是元素周期表短周期的一部分,下列说法中正确的是( )
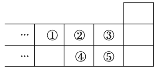
A. 元素①位于第二周期第ⅣA族
B. 气态氢化物的稳定性:④>②
C. 最高价氧化物对应水化物的酸性:⑤>④
D. 元素的最高正化合价:③=⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是
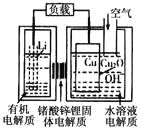
A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,正极的电极反应式为O2+2H2O+4e-==4OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如图:
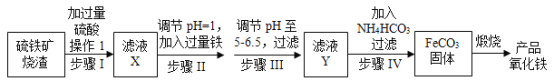
试回答下列问题:
(1)滤液X中含有的金属阳离子是___(填离子符号)。
(2)步骤Ⅱ中发生反应的离子方程式为_____。
(3)步骤Ⅲ中最好可选用___(填字母)调节溶液的pH。
A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(4)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是___。
(5)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是______。
(6)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如图:
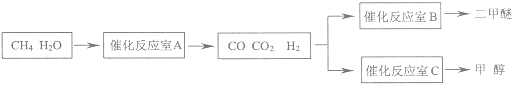
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为___。
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……(Ⅰ)
CO(g)+3H2(g)……(Ⅰ)
CO(g)+H2O(g)![]() CO2(g)+H2(g)……(Ⅱ)
CO2(g)+H2(g)……(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)![]() CH3OH(g)……(Ⅲ)
CH3OH(g)……(Ⅲ)
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率=![]() ×100%。试求反应(Ⅳ)的原子利用率为___。
×100%。试求反应(Ⅳ)的原子利用率为___。
②反应(Ⅳ)的△S___0(填“>”、“=”或“<”)。
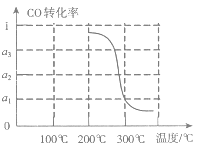
③在压强为5MPa,体积为V L的反应室c中,a mol CO与2a mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如图。则该反应的△H___0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K=___(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。该燃料电池负极的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入 NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下V L的废气,计算消耗二甲醚的质量___。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A,为了研究其结构和性质,进行如下实验:
(1)用质谱法测得A的相对分子质量为136,经测定A中只含C、H、O三种元素,且C的质量分数为70.6%,H的质量分数为5.9%,则A的分子式是_____
(2)经测定A是一种芳香族化合物,且能发生银镜反应,能与金属钠反应生成气体,不能与![]() 发生显色反应,其核磁共振氢谱有5组峰,峰面积之比为1∶1∶2∶2∶2,则该有机物所含官能团的名称是____,结构简式是______
发生显色反应,其核磁共振氢谱有5组峰,峰面积之比为1∶1∶2∶2∶2,则该有机物所含官能团的名称是____,结构简式是______
(3)A与新制氢氧化铜反应的化学方程式_______
(4)满足下列条件的A的同分异构体有_____种
①能发生银镜反应 ②能与![]() 发生显色反应
发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,1molFe分别与足量的盐酸和水蒸气反应转移的电子数均为2NA
B. 11.2LH2中含有的原子数为NA
C. Na2O与Na2O2的混合物共1mol,阴离子数目为NA
D. 1.0L1mol/L的Na2SO4水溶液中含有的氧原子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A的产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如图所示:
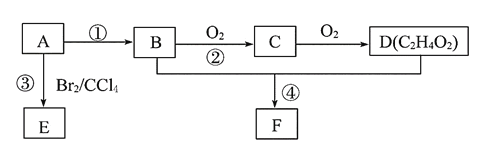
(1)A的结构式为______,D中官能团的名称为_____。
(2)反应③的化学方程式为___________。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2~3次。该反应的化学方程式为___________。
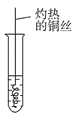
(4)B、D在浓硫酸的作用下实现反应④,实验装置如图所示,试管1中装入药品后加热。图中X的化学式为______。试管1中反应的化学方程式为__________。
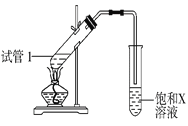
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL 0.01mol·L-1NaA溶液中逐滴加入0.01mol·L-1的盐酸,滴定曲线如图所示,下列表述不正确的是
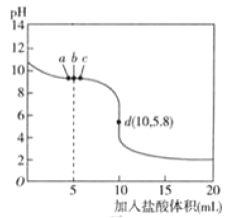
A.图中的a点可能存在![]()
B.b点时,溶液中微粒浓度大小的关系:![]()
C.在c点的溶液中:![]()
D.d点溶液存在的关系:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com