
【题目】一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是
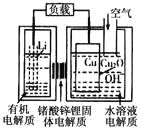
A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,正极的电极反应式为O2+2H2O+4e-==4OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醇(![]() )是一种重要的化工原料,
)是一种重要的化工原料,
Ⅰ.在一定条件下以CO和H2为原料可以合成乙二醇,反应方程式如下:
2CO(g)+3H2(g) ![]()
![]() (g) ΔH= a kJ/mol
(g) ΔH= a kJ/mol
(1)该反应能够自发进行,可以推出a 0;(填“>”“<”或“=”)。
(2)在一定温度下,向体积为1L的恒容密闭容器中充入2 mol CO (g)和3mol H2(g),压强为P1,达到平衡时压强变为P2,且P1:P2=15:7,则该温度下的化学平衡常数K=______
(3)只改变反应的一个条件,能使平衡体系中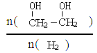 增大的措施有 (写两条)
增大的措施有 (写两条)
Ⅱ.乙二醇经连续催化氧化后可得到乙二酸(HOOC-COOH),乙二酸俗称草酸,分子式可以用H2C2O4表示,H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.0×10-2,K2=5.0×10-5
(1)H2C2O4的电离方程式为 。
(2)Na2C2O4溶液显 (填“酸性”、“中性”或“碱性”),溶液中各离子浓度从大到小的顺序为 。
(3)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,常温下,
反应NH3·H2O + HC2O4- ![]() NH4+ +C2O42-+H2O的平衡常数K= 。
NH4+ +C2O42-+H2O的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
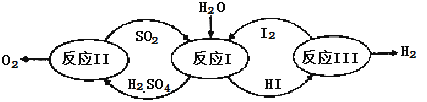
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
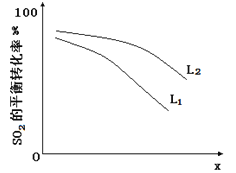
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池由A、B、C、D四种金属按下表中装置图进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________。
(2)装置乙中正极的电极反应式是________________________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,
[Cu(OH)4] 2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
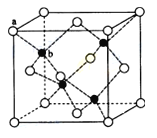
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0pm,密度为________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为______________pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)下图是实验室用氢气还原氧化铜实验的简易装置。其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中。
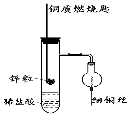

(1)铜质燃烧匙的作用有 , 。
(2)实验过程中,在试管M中可观察到的现象是 , 。
(二)原电池与电解池在化学工业中有广泛应用。如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
(1)若断开k1,闭合k2,则装置为_____ ;X电极上的电极反应式为_____________;电解质溶液中的阳离子向______极移动(填X或Y);
(2)若线路中通过3.01×1022的电子,则Y极上析出物质的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如下图所示。 又知AgCl的Ksp=1.8×10-10。下列说法正确的是( )
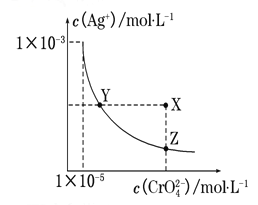
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,B的最简单气态氢化物能引起温室效应,D原子核外电子有8种不同的运动状态, E是用途最广泛的金属,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子。
(1)E元素在周期表中的位置 ;F+的电子排布式为 。
(2)化合物BD(CA2)2中,B原子的杂化方式为 ,1mol该分子中σ键数目为 个,该物质易溶于水的主要原因是 _ _____________。
(3)ACD3中阴离子CD3-的空间构型为 ,ACD3酸性比ACD2强,原因是___________。
(4)根据等电子体原理,BD分子的电子式为 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于 晶体。
(5)3g B2A6在足量氧气中燃烧并恢复到室温,放出Q kJ热量,则表示B2A6燃烧热的热化学方程式为
______ _ _____________。
(6)将F单质粉末加入到CA3的浓溶液中,并通入D2,充分反应后溶液呈深蓝色,写出该反应的化学方程式 _ _____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com