
����Ŀ��������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ��������ͼ��ʾ��
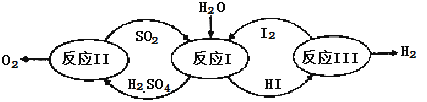
��1����Ӧ��Ļ�ѧ����ʽ�� ��
��2����Ӧ��õ��IJ�����I2���з��롣�ò������Һ�ڹ���I2�Ĵ����»�ֳ����㡪������Ũ��I2��H2SO4���Ũ�ȵ�I2��HI�㡣
�ٸ���������ʵ������˵����ȷ���� ��ѡ����ţ���
a��������Һ���ܶȴ��ڲ���
b����I2ǰ��H2SO4��Һ��HI��Һ������
c��I2��HI��Һ�б���H2SO4��Һ������
�ڱ��������Һ�ķ����� ��
�۾���⣬H2SO4����c��H+����c��SO42-��=2.06��1�����ֵ����2��ԭ���� ��
��3����Ӧ��2H2SO4��l��=2SO2��g��+O2��g��+2H2O��g�� ��H=+550kJ/mol
����������Ӧ��ɣ�i��H2SO4��l��=SO3��g�� +H2O��g�� ��H=+177kJ/mol
ii��SO3��g���ֽ⡣
L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ��ii��SO3��g����ƽ��ת������X�ı仯��ϵ��
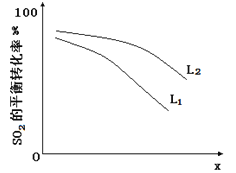
��X�������������� ��
���ж�L1��L2�Ĵ�С��ϵ�����������ɣ� ��
���𰸡���1��SO2 + 2H2O + I2 = H2SO4 + 2HI
��2����a��c�ڹ۲���ɫ����ɫ�����HI�㣬��ɫdz����������������к�������HI
��3����ѹǿ ��L2>L1 2SO3��g��= 2SO2��g��+O2��g����H=+196kJ/mol,ѹǿһ��ʱ���¶����ߣ�ƽ��ת��������
��������
�����������1������ͼ����Ϣ��֪��Ӧ���з�Ӧ��ΪSO2��H2O��I2��������ΪH2SO4��HI������������ԭ��Ӧ����ʽ����ƽ������ƽ����2���ټ���I2ǰ��Һδ���ֲַ㣬����I2����HI��Һ���ܽ�ȴ�����H2SO4��Һ���ܽ�ȣ�����Һ���ܶȴ��ڲ��죬�ʳ��ֲַ��������� I2 + H2O![]() HI +HIO�����������Һ�ж�����I2��H+��I-��HIO�ȣ�����������Һ��ֻ��ͨ������SO42-�����������Һ����H2SO4��Һ�����е�Ũ�ȵĵ⣬�ⵥ�ʿ���ˮ������Ӧ I2 + H2O
HI +HIO�����������Һ�ж�����I2��H+��I-��HIO�ȣ�����������Һ��ֻ��ͨ������SO42-�����������Һ����H2SO4��Һ�����е�Ũ�ȵĵ⣬�ⵥ�ʿ���ˮ������Ӧ I2 + H2O![]() HI +HIO��c��H+������ʹ��Һ��c��H+��:c��SO42-���ı�ֵ����2����3�����ݷ�Ӧ��Ͳ��袡д�����袢���Ȼ�ѧ��Ӧ����ʽΪ��2SO3��g��= 2SO2��g��+O2��g����H=+196KJmol-1�ٸ÷�Ӧ����ӦΪ�����������ķ�Ӧ��ѹǿ����ƽ�������ƶ���SO3��ת���ʼ�С����X������������Ϊѹǿ���ڸ��ݢٿ�֪L������������Ϊ�¶ȡ��÷�Ӧ������ӦΪ���ȷ�Ӧ����ͬѹǿʱ���¶����ߣ�ƽ�������ƶ���SO3��ת��������L2>L1��
HI +HIO��c��H+������ʹ��Һ��c��H+��:c��SO42-���ı�ֵ����2����3�����ݷ�Ӧ��Ͳ��袡д�����袢���Ȼ�ѧ��Ӧ����ʽΪ��2SO3��g��= 2SO2��g��+O2��g����H=+196KJmol-1�ٸ÷�Ӧ����ӦΪ�����������ķ�Ӧ��ѹǿ����ƽ�������ƶ���SO3��ת���ʼ�С����X������������Ϊѹǿ���ڸ��ݢٿ�֪L������������Ϊ�¶ȡ��÷�Ӧ������ӦΪ���ȷ�Ӧ����ͬѹǿʱ���¶����ߣ�ƽ�������ƶ���SO3��ת��������L2>L1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ�д�����������������й����ʵĽṹ��ʽ��ѧ����ʽ��
��1����������Ʒ�Ӧ�����������������Ʒ�Ӧ�ķ����廯����C7H8O�� ��
��2������ʽΪC3H7Br��±��������ȥ��Ӧ��õ����л����� ��
��3����C��H��O����Ԫ�ص��л����ȫȼ��ʱ���ĵ����������ɵ�CO2��H2O֮�����ʵ���֮��Ϊ1��1��1��������л��������һ���� ��
��4�������뱥����ˮ�ķ�Ӧ����ʽΪ ���÷�Ӧ���ڱ��ӵ� �� ��
��5��TNT��2��4��6-�������ױ�����һ������ըҩ���㷺���ڹ�����������·�ȣ�д���Ʊ�TNT�ķ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�� W��X��Y��Z ��Ԫ�����ڱ��е�λ������ͼ��ʾ������ Z �ĵ�����һ����Ҫ�뵼����ϣ��㷺Ӧ���ڵ��ӹ�ҵ�ĸ�������
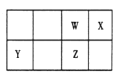
��1��W ��Ԫ�����ڱ��е�λ����____________��
��2��W��X����Ԫ���γɵ���ԭ�ӷ��ӵĵ���ʽ____________��
��3������ѡ���У���֤��Ԫ�طǽ�����Xǿ��W����____________��
A�����ԭ��������X>W | B����ͻ��ϼۣ�X>W |
C������⻯����ȶ��ԣ�X>W | D������������ˮ�������ԣ�X>W |
��4��Ԫ�����ڱ����� Z ͬ���ڵ�ij����Ԫ���γɵĵ��� A���ɷ�������ͼ��ʾ��ת����
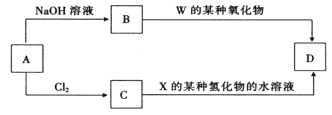
���л�����D��һ�ְ�ɫ�������� B �����ʵĻ�ѧʽΪ____________��
B�� CҲ��ֱ��ת������ D д����Ӧ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������ɫ�Ĵ��Խ�����ǿ�Ȳ������������̼ӵ������У���Ȼ��ʹ������ǿ�����4��8�������һ�����˸ֵ���ĥ�ԣ������̸��ڹ�ũҵ�������������������Ź㷺����;��
��������Ĥ��ⷨ���¼����Ӻ���MnCO3��MnO2��FeCO3��SiO2��Al2O3�ȳɷֵ��̿�ʯ����ȡ�����̣��乤������������
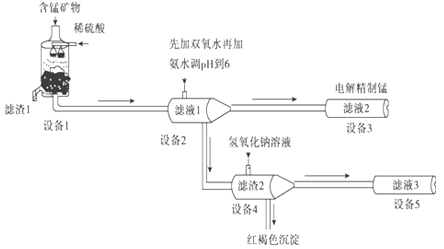
��֪FeCO3��MnCO3������ˮ��
��1���豸1�з�Ӧ����Һ1����Ԫ��ֻ��Mn2+����ʽ���ڣ�������1��Ҳ��MnO2��������1����Ҫ�ɷ���_________(�ѧʽ)��
��2���豸1�з���������ԭ��Ӧ�����ӷ���ʽ��_________��
��3���豸2�м�����˫��ˮ��������_________�����ʵ�鷽��������Һ2���Ƿ����Fe2+:_________��
��4���豸4�м����������������Һ�����������ܽ⣮�û�ѧƽ���ƶ�ԭ������ԭ��_________��
��5���豸3����������Ĥ����ȡ�����̵ĵ��װ����ͼ��
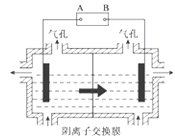
�����װ���м�ͷ��ʾ��Һ���������ƶ��ķ�����A�缫��ֱ����Դ��_________����ʵ�������У�������ϡ����Ϊ���Һ����缫��ӦʽΪ_________��
���ù���֮���Բ��������ӽ���Ĥ����Ϊ�˷�ֹMn2+������������������Ӧ����MnO2�����Դ�˷ѣ�д���ø���Ӧ�ĵ缫��Ӧʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ��屽��ʵ��װ������ͼ����Һ��Ӻ�ѹ��Һ©����������ʢ�б������۵���ƿA����Ӧ������A�е�Һ����к����������ɻ��������
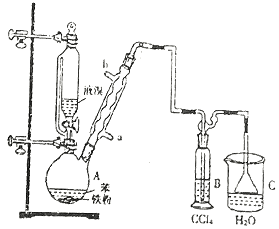
��1��д��A���Ʊ������Ļ�ѧ��Ӧ����ʽ______________��
��2�� B��ʢ�ŵ�CCl4��������______________
��3�������ܵ�������______________���������е�ˮӦ��______________�ڽ���(����a������b��)��
��4����C�м�����������Һ��֤������Һ����������ȡ����Ӧ�����Ǽӳɷ�Ӧ����Ӧ������______________��Ҳ��ʹ��______________��ֽ������֤���������ۡ�
��5���õ���������Ҫ�����²�����������������ˮϴ���ø����������10%NaOH��Һϴ����ȷ�IJ���˳����______________(����ĸ���)��
a.�٢ڢۢܢ� b.�ڢܢڢۢ� c.�ܢڢۢ٢� d.�ڢܢ٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��FeCl3��Ч���Ҹ�ʴ��С����ش��������⣺
��1��FeCl3��ˮ��ԭ���� ��FeCl3 ��Һ��ʴ�����豸����H�������⣬��һ��Ҫԭ���ǣ������ӷ���ʽ��ʾ�� ��
��2��Ϊ��Լ�ɱ�����ҵ����NaClO3 ��������FeCl2 ��Һ�õ�FeCl3��
��������FeCl2��Һ��c(Fe2��)=2.0��10-2mol��L-1��c(Fe3��)=1.0��10-3mol��L-1��c(Cl��)=5.3��10-2mol��L-1�������Һ��PHԼΪ ��
�����NaClO3 ����FeCl2 �����ӷ���ʽ��![]()
��3��FeCl3 ����Һ�з�����ˮ����
Fe3��+H2O ![]() Fe(OH)2++H�� K1
Fe(OH)2++H�� K1
Fe(OH)2++H2O![]() Fe(OH)2++H�� K2
Fe(OH)2++H�� K2
Fe(OH)++H2O![]() Fe(OH)3+H�� K3
Fe(OH)3+H�� K3
����ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳���� ��
ͨ����������������ˮ�����ۺϣ����ɾۺ������������ӷ���ʽΪ��xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
��ʹƽ�������ƶ��ɲ��õķ����ǣ�����ţ� ��
a������ b����ˮϡ��
c������NH4Cl d������NaHCO3
�����£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ������� ��
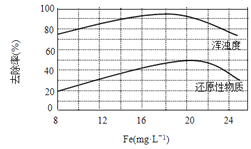
��4�����ij��ˮ���������Ȼ���������ˮ�Ľ������ͼ��ʾ����ͼ�����ݵó�ÿ����ˮ��Ͷ�žۺ��Ȼ���[��Fe(mg��L-1)��ʾ]����ѷ�ΧԼΪ mg��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һͭ����ȼ�ϵ�������ߡ��ɱ��ͣ����й����ķ�չǰ�����õ��ͨ��һ�ָ��ӵ�ͭ��ʴ���������������ܣ����зŵ����Ϊ2Li+Cu2O+H2O==2Cu+2Li��+2OH��������˵������ȷ����
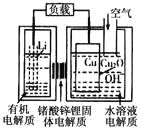
A. �ŵ�ʱ��Li��������������Cu���ƶ�
B. �ŵ�ʱ�������ĵ缫��ӦʽΪO2+2H2O+4e��==4OH��
C. ͨ����ʱ��ͭ����ʴ���������Cu2O
D. ������Ӧ�����У�������ΪO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ұ���һ����;�㷺���л�ԭ�ϣ����Ʊ����ֻ�����Ʒ��
(һ)�Ʊ�����ϩ(ԭ���練ӦI��ʾ):

��1����ҵ�ϣ��ں�ѹ�豸�н��з�ӦIʱ�������ұ�������ͨ��һ������ˮ�������û�ѧƽ�����۽���ͨ��ˮ������ԭ��Ϊ ��
��2������ϵ�����ܱ仯�ĽǶȷ�������ӦI��____(��������������������)�����������Է����С�
(��)�Ʊ���-���һ���(ԭ���練ӦII��ʾ):

��3��T��ʱ����10 L�����ܱ������г���2mol�ұ�(g)��2 mol Cl2(g)������Ӧ����5 minʱ�ﵽƽ�⣬�ұ���Cl2����-���һ�����HC1�����ʵ���Ũ��(c)��ʱ��(t)�仯��������ͼl��ʾ��


��0��5 min�ڣ���HC1��ʾ�ĸ÷�Ӧ����v(HCl)=____ ��
��T��ʱ���÷�Ӧ��ƽ�ⳣ��K=____ ��
��6 minʱ���ı���������Ϊ________��
��10 minʱ�����������������䣬���������г���1mol�ұ���1 mol Cl2��1 mol ��-���һ��� ��l mol HCl��12 minʱ�ﵽ��ƽ�⡣��ͼ2�л���10-12 min��Cl2��HCl��Ũ�ȱ仯����(�����ϱ���Cl2��HCl)��0��5 min��0��12 minʱ��Σ�Cl2��ת���ʷֱ�����1����2 ��ʾ������l ��2(����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��ͬѧ����ij���Ȼ�ϵ�NaHCO3��KHCO3��Ʒ����ʵ�飬���ʵ������ͼ��ʾ

��֪�����������������Ϊ��״��
������������ʵ���Ũ����ȣ����������50mL���Լ��㣺
��1����������ʵ���Ũ�� mol��L-1��
��2���������Ʒ�У�NaHCO3��KHCO3�����ʵ���֮�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com