
����Ŀ������һ������ɫ�Ĵ��Խ�����ǿ�Ȳ������������̼ӵ������У���Ȼ��ʹ������ǿ�����4��8�������һ�����˸ֵ���ĥ�ԣ������̸��ڹ�ũҵ�������������������Ź㷺����;��
��������Ĥ��ⷨ���¼����Ӻ���MnCO3��MnO2��FeCO3��SiO2��Al2O3�ȳɷֵ��̿�ʯ����ȡ�����̣��乤������������
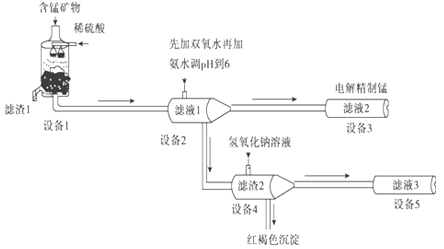
��֪FeCO3��MnCO3������ˮ��
��1���豸1�з�Ӧ����Һ1����Ԫ��ֻ��Mn2+����ʽ���ڣ�������1��Ҳ��MnO2��������1����Ҫ�ɷ���_________(�ѧʽ)��
��2���豸1�з���������ԭ��Ӧ�����ӷ���ʽ��_________��
��3���豸2�м�����˫��ˮ��������_________�����ʵ�鷽��������Һ2���Ƿ����Fe2+:_________��
��4���豸4�м����������������Һ�����������ܽ⣮�û�ѧƽ���ƶ�ԭ������ԭ��_________��
��5���豸3����������Ĥ����ȡ�����̵ĵ��װ����ͼ��
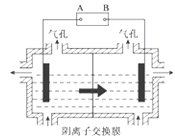
�����װ���м�ͷ��ʾ��Һ���������ƶ��ķ�����A�缫��ֱ����Դ��_________����ʵ�������У�������ϡ����Ϊ���Һ����缫��ӦʽΪ_________��
���ù���֮���Բ��������ӽ���Ĥ����Ϊ�˷�ֹMn2+������������������Ӧ����MnO2�����Դ�˷ѣ�д���ø���Ӧ�ĵ缫��Ӧʽ_________��
���𰸡���1��SiO2����2��2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O ��2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2��+4H2O��
��3����Fe2+��ȫ����ΪFe3+��ȡ��Һ2���������軯����Һ���������ɫ��������������Fe2+������û��Fe2+����4������2�д���Al(OH)3�����ڵ���ƽ�⣺Al3++3OH-![]() Al(OH)3
Al(OH)3![]() AlO2-+H++H2O������NaOH��Һ��H+���кͣ�Ũ�ȼ��ͣ�Al(OH)3�����ܽ⣻
AlO2-+H++H2O������NaOH��Һ��H+���кͣ�Ũ�ȼ��ͣ�Al(OH)3�����ܽ⣻
��5����������4OH--4e-=2H2O+O2������Mn2++2H2O-2e-=MnO2+4H+��
��������
����������̿������Ҫ�ɷ���MnCO3��MnO2��FeCO3��SiO2��Al2O3�ȣ��������ܽ⣬SiO2�����ᷴӦ��MnCO3��FeCO3��Al2O3�����ᷴӦ�õ�MnSO4��FeSO4��Al2(SO4)3������Һ1����Ԫ��ֻ��Mn2+����ʽ���ڣ�������1��Ҳ��MnO2������������MnO2��Fe2+��������ΪFe3+���ӣ����˳�ȥ��������Ȳ��������1ΪSiO2�Ȳ������Һ1�м���������⽫Fe2+��������ΪFe3+���ӣ��ټ��백ˮ������ҺpHʹFe3+��Al3+ת��ΪFe(OH)3��Al(OH)3���������˷��룬��Һ2�к���MnSO4��NH4SO4�ȣ�����2ΪFe(OH)3��Al(OH)3��������2�м����������ƣ����������ܽ�õ�NaAlO2�����˷��룮��Һ2���õ�Mn��
��1�����ݷ�����֪������1����Ҫ�ɷ���SiO2���ʴ�Ϊ��SiO2��
��2���豸1�з���������ԭ��Ӧ���������������������½�+2��������Ϊ�����ӣ���������ԭ�õ�Mn2+����Ӧ���ӷ���ʽΪ��2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O ��2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2��+4H2O���ʴ�Ϊ��2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O ��2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2��+4H2O��
��3���豸2�м�����˫��ˮ��Fe2+��������ΪFe3+���ӣ����ڵ���pHʱת��Ϊ������ȥ��������Һ2���Ƿ����Fe2+�ķ���Ϊ��ȡ��Һ2���������軯����Һ���������ɫ��������������Fe2+������û��Fe2+���ʴ�Ϊ����Fe2+��ȫ����ΪFe3+��ȡ��Һ2���������軯����Һ���������ɫ��������������Fe2+������û��Fe2+��
��4�����ݷ�����֪������2�д���Al(OH)3�����ڵ���ƽ�⣺Al3++3OH-![]() Al(OH)3
Al(OH)3![]() AlO2-+H++H2O������NaOH��Һ��H+���кͣ�Ũ�ȼ��ͣ�����Al(OH)3�����ܽ⣬�ʴ�Ϊ������2�д���Al(OH)3�����ڵ���ƽ�⣺Al3++3OH-
AlO2-+H++H2O������NaOH��Һ��H+���кͣ�Ũ�ȼ��ͣ�����Al(OH)3�����ܽ⣬�ʴ�Ϊ������2�д���Al(OH)3�����ڵ���ƽ�⣺Al3++3OH-![]() Al(OH)3
Al(OH)3![]() AlO2-+H++H2O������NaOH��Һ��H+���кͣ�Ũ�ȼ��ͣ�Al(OH)3�����ܽ⣻
AlO2-+H++H2O������NaOH��Һ��H+���кͣ�Ũ�ȼ��ͣ�Al(OH)3�����ܽ⣻
��5�������װ���м�ͷ��ʾ��Һ���������ƶ��ķ���������Ϊ�����ң�����Ϊ�����ң�AΪ��Դ�ĸ�����BΪ��Դ��������������ϡ����Ϊ���Һ����Һ�����������ӷŵ������������缫��ӦΪ��4OH--4e-=2H2O+O2�����ʴ�Ϊ��������4OH--4e-=2H2O+O2����
��Mn2+����������������������Ӧ����MnO2����Ҫ��ˮ���뷴Ӧ�����ݵ���غ��֪�����������ɣ��ø���Ӧ�ĵ缫��Ӧʽ��Mn2++2H2O-2e-=MnO2+4H+���ʴ�Ϊ��Mn2++2H2O-2e-=MnO2+4H+��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£�ˮ��Һ��c(H��)��c(OH��)����ͼ��ʾ��ϵ�����������������ӹ���˵������ȷ����( )
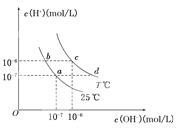
A��a���Ӧ����Һ�д������ڣ�Fe3+��Na+��Cl�D��SO42�D
B��b���Ӧ����Һ�д������ڣ�NH4+��Ba2+��OH�D��I�D
C��c���Ӧ����Һ�д������ڣ�Na+��Ba2+��Cl�D��HCO3�D
D��d���Ӧ����Һ�д������ڣ�Na+��K+��SO32�D��Cl�D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ����
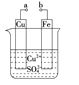
A��a��b������ʱ����Ƭ�ϻ��н���ͭ����
B��a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪ��Cu2����2e��===Cu
C������a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ������ɫ���dz��ɫ
D��a��b����ʱ��ͭƬ�Ϸ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���dz��Ը���Ϊԭ�����ǣ�ͬʱ�õ������ĸ��������Ը����������ۺ����ò���������߾���Ч�棬�����ܹ���ֹ������Ⱦ���ְ����·�ʽ���д������ã�
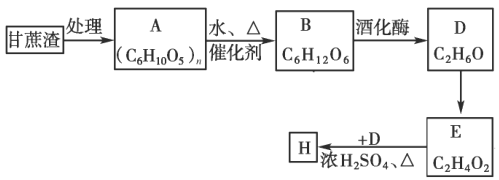
�Իش�
��1��A��������____________��
��2��д��D��ͬ���칹��Ľṹ��ʽ____________��
��3��D��E�ķ�Ӧ����Ϊ____________��D��E�ķ�Ӧ�Լ�����Ϊ____________��
��4��ʵ�����Ʊ�H���ᴿH�ķ��뷽��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ�����![]() ����һ����Ҫ�Ļ���ԭ�ϣ�
����һ����Ҫ�Ļ���ԭ�ϣ�
��.��һ����������CO��H2Ϊԭ�Ͽ��Ժϳ��Ҷ�������Ӧ����ʽ���£�
2CO(g)��3H2(g) ![]()
![]() (g) ��H= a kJ/mol
(g) ��H= a kJ/mol
��1���÷�Ӧ�ܹ��Է����У������Ƴ�a 0�����>����<����=������
��2����һ���¶��£������Ϊ1L�ĺ����ܱ������г���2 mol CO (g)��3mol H2(g)��ѹǿΪP1���ﵽƽ��ʱѹǿ��ΪP2����P1:P2=15:7������¶��µĻ�ѧƽ�ⳣ��K=______
��3��ֻ�ı䷴Ӧ��һ����������ʹƽ����ϵ�� ����Ĵ�ʩ�� ��д������
����Ĵ�ʩ�� ��д������
��.�Ҷ�����������������ɵõ��Ҷ��ᣨHOOC-COOH�����Ҷ����׳Ʋ��ᣬ����ʽ������H2C2O4��ʾ��H2C2O4��һ�ֶ�Ԫ���ᣬ�����������ƽ�ⳣ��K1=5.0��10-2��K2=5.0��10-5
��1��H2C2O4�ĵ��뷽��ʽΪ ��
��2��Na2C2O4��Һ�� ������ԡ��������ԡ����ԡ�������Һ�и�����Ũ�ȴӴ�С��˳��Ϊ ��
��3����֪������NH3��H2O�ĵ���ƽ�ⳣ��K=1.75��10-5�������£�
��ӦNH3��H2O + HC2O4- ![]() NH4+ +C2O42-+H2O��ƽ�ⳣ��K= ��
NH4+ +C2O42-+H2O��ƽ�ⳣ��K= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ��屽��ʵ��װ������ͼ��ʾ�����ش�����������
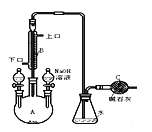
��1����Ӧ��ʼǰ��������A�м���Ĺ���ҩƷ�����ۣ���װ������Һ©���е�Һ��ҩƷ�� ��
��2��д��ʵ�������屽�Ļ�ѧ����ʽ ��
��3���÷�Ӧװ����������B���ϡ��������ڣ���ȴˮӦ�� �ڽ��루��������������������
��4���Ҳ��Һ©���е������� ����A�У�������Ӧǰ��������Ӧ����������Ӧ�������������ӷ���ʽ��ʾ�������� ��
��5��C�м�ʯ�ҵ������� ��
��6���ù��̿������±�����3Br2��2Fe��2FeBr3 �� Br2��FeBr3��FeBr4����Br+ �����ȶ��� ��
![]() ��Br+��[
��Br+��[![]() ] �� [
] �� [![]() ]��FeBr4����
]��FeBr4����![]() ��HBr��FeBr3 ��
��HBr��FeBr3 ��
��������Ӧ����֪��![]() ��Br2 ��
��Br2 �� ![]() ��HBr �еĴ���Ϊ ��������ĸ��
��HBr �еĴ���Ϊ ��������ĸ��
A. Br2 B.FeBr3 C.Br+ D.FeBr4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ��������ͼ��ʾ��
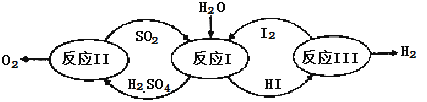
��1����Ӧ��Ļ�ѧ����ʽ�� ��
��2����Ӧ��õ��IJ�����I2���з��롣�ò������Һ�ڹ���I2�Ĵ����»�ֳ����㡪������Ũ��I2��H2SO4���Ũ�ȵ�I2��HI�㡣
�ٸ���������ʵ������˵����ȷ���� ��ѡ����ţ���
a��������Һ���ܶȴ��ڲ���
b����I2ǰ��H2SO4��Һ��HI��Һ������
c��I2��HI��Һ�б���H2SO4��Һ������
�ڱ��������Һ�ķ����� ��
�۾���⣬H2SO4����c��H+����c��SO42-��=2.06��1�����ֵ����2��ԭ���� ��
��3����Ӧ��2H2SO4��l��=2SO2��g��+O2��g��+2H2O��g�� ��H=+550kJ/mol
����������Ӧ��ɣ�i��H2SO4��l��=SO3��g�� +H2O��g�� ��H=+177kJ/mol
ii��SO3��g���ֽ⡣
L��L1��L2����X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ��ii��SO3��g����ƽ��ת������X�ı仯��ϵ��
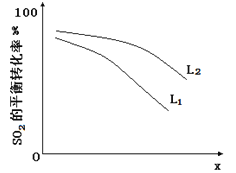
��X�������������� ��
���ж�L1��L2�Ĵ�С��ϵ�����������ɣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��3�����ʽṹ�����ʡ�CuSO4�ڻ��п����Ҫ�ɷ���ZnS����������Ҫ���ã���Ҫ�ǻ����������CuS��Cu2S��һϵ��ͭ��������֡�
��1��Cu2����̬�ĵ����Ų�ʽ�ɱ�ʾΪ ��
��2��SO42���Ŀռ乹��Ϊ (����������)������ԭ�Ӳ��õĹ���ӻ���ʽ�� ��д��һ����SO42����Ϊ�ȵ�����ķ��ӵĻ�ѧʽ�� ��
��3����CuSO4 ��Һ�м������NaOH��Һ������[Cu (OH)4 ]2���������ǿռ乹�ͣ�
[Cu(OH)4] 2���Ľṹ����ʾ��ͼ��ʾΪ ��
��4��������ʾZnSΪ������ڻ�����У�CuSO4��ת��ΪCuS��ԭ���� ��
��5��CuS��CuO���۵� �����ͣ���ԭ���� ��
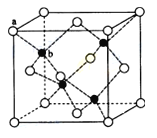
��6����п�����Ҫ�ɷ�ZnS������ṹ����ͼ��ʾ���侧���߳�Ϊ540.0pm���ܶ�Ϊ________(��ʽ������)��aλ��S2��������bλ��Zn2������֮��ľ���Ϊ______________pm(��ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ĵ���ʽ ����Ԫ�غ�����ߵ����ķ���ʽ______________��
��2��֧��ֻ��һ���һ�����Է���������С�������Ľṹ��ʽΪ
��3��ijȲ����������õ�2-�����飬��Ȳ���������� ��ϵͳ������������
��4����֪ij�л���Ľṹ��ʽΪ��![]()
�����л��������������ŵ�������________________��_______________��
��д�����л���ʹ��ˮ��ɫ�ķ�Ӧ��ѧ����ʽ_____________________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com