
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是( )
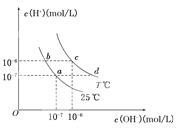
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl―、SO42―
B.b点对应的溶液中大量存在:NH4+、Ba2+、OH―、I―
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl―、HCO3―
D.d点对应的溶液中大量存在:Na+、K+、SO32―、Cl―
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。下列说法正确的是
A.简单离子半径:r(W)>r(Z)>r(Y)
B.Y的简单气态氢化物的还原性比Z的弱
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NH2COO-+2H2O![]() HCO3-+NH3˙H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是
HCO3-+NH3˙H2O。现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是

A.无法判断T1和T2的大小关系
B.T1℃时,第6min反应物转化率为6.25%
C.T2℃时,0~6minν(NH2COO-)=0.3molL-1min-1
D.往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | |||
3 | ⑦ | ⑧ | ⑨ | |||||
4 | ⑩ |
(1)在这些元素中,化学性质最不活泼的是 ,元素原子半径最小的是 ,被称为“国防金属”的是 ,可作为半导体材料的是 ,单质氧化性最强的元素是 。
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是 。
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是 。酸性最强的化合物的化学式是 。
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式 。
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大。五种元素中,仅R为金属元素,其原子序数为27。X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个。
根据判断出的元素回答下列问题:

(1)基态R原子核外电子排布式为 。
(2)1mol配合物[R(XY)6]4-中含有σ键的数目为 。
(3)XZW2是一种高毒类物质,结构与甲醛相似,X原子杂化方式为 ,其沸点高于甲醛的主要原因是 。
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为 (用文字描述)。
(5)R与某元素A构成的晶体的晶胞结构如下图所示,则R的配位数是 ,A的配位数是 。
(6)在答卷的图中画出与顶点m配位的所有A原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)欲从苯酚的乙醇溶液中回收苯酚,有下列操作,合理的顺序是 (填字母)。
①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤通入过量CO2
⑥加入足量NaOH 溶液 ⑦加入足量FeCl3溶液 ⑧加入足量浓溴水
A. ⑧ ② B.⑥ ① ⑤ ③ C.④② D.⑦ ① ③
(2)下列说法正确的是 (填序号)。
①麦芽糖及其水解产物均能发生银镜反应,且试管内壁的银镜需用稀氨水洗涤
②蛋白质溶液中加入饱和硫酸铵溶液,有沉淀析出,加水后沉淀也不溶解
③淀粉液中加入几滴稀硫酸加热几分钟,冷却后加入银氨溶液并水浴加热,没有观察到银镜现象,证明淀粉未发生水解
④只用溴水就能鉴别四氯化碳、甲苯、乙烯、乙醇
Ⅱ已知:CH3CH2OH+NaBr+H2SO4(浓) ![]() CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置如图:圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
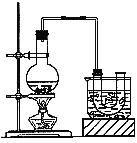
(1)反应时若温度过高会降低溴乙烷的产率,原因是 ;也可看到有红棕色气体产生,该气体的化学式为 。为避免温度过高,宜采用 加热。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去其中的杂质,最好选用下列试剂中的
(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
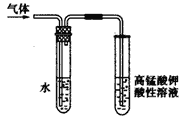
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用右图所示装置进行实验:该实验的目的是 。 盛水的试管(装置)的作用是 。
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后 (填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别写出满足下列叙述中有关物质的结构简式或化学方程式:
(1)能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O是 。
(2)分子式为C3H7Br的卤代烃经消去反应后得到的有机物是 ;
(3)含C、H、O三种元素的有机物,完全燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:1:1,则此类有机物中最简单的一种是 。
(4)苯酚与饱和溴水的反应方程式为 ,该反应用于苯酚的 和 。
(5)TNT(2,4,6-三硝基甲苯)是一种烈性炸药,广泛用于国防、开矿、筑路等,写出制备TNT的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
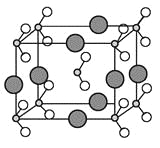
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰是一种银白色的脆性金属,强度不如铁,但把锰加到钢铁中,竟然能使钢铁的强度提高4~8倍,而且还提高了钢的耐磨性,所以锰钢在工农业生产及国防建设中有着广泛的用途。
用阴离子膜电解法的新技术从含有MnCO3、MnO2、FeCO3、SiO2、Al2O3等成分的锰矿石中提取金属锰,其工艺流程如下:
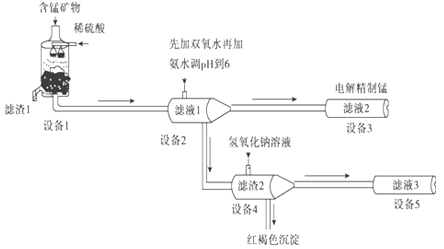
已知FeCO3、MnCO3难溶于水.
(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2.则滤渣1的主要成分是_________(填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是_________。
(3)设备2中加足量双氧水的作用是_________。设计实验方案检验滤液2中是否存在Fe2+:_________。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解.用化学平衡移动原理解释原因:_________。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:
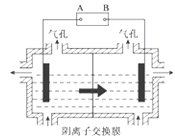
①电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的_________极。实际生产中,阳极以稀硫酸为电解液,其电极反应式为_________。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com