
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:![]()
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O ![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
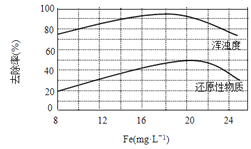
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
【答案】(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 2 Fe3++Fe=3 Fe2+
(2)①2 ②1 6 6H+ 1 6 3H2O
(3)K1>K2>K3 bd 调节溶液的pH(4)18~20
【解析】
试题分析:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质 ,所以可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是2 Fe3++Fe=3 Fe2+
(2)①根据电荷守恒,则溶液中氢离子的浓度是c(Cl-) -2 c(Fe2+)-3 c(Fe3+)=1.0×10-2mol·L-1,所以pH=2;②根据题意,氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3;使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,所以答案选bd;从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH。
(4)由图像可知,聚合氯化铁的浓度在18~20 mg·L-1时,去除率达到最大值,污水的浑浊度减小。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于粒子结构的描述不正确的是( )。
A. H2S和NH3均是价电子总数为8的分子
B. HS-和HCl均是含一个极性键的18电子粒子
C. CO2的电子式为![]()
D. 1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
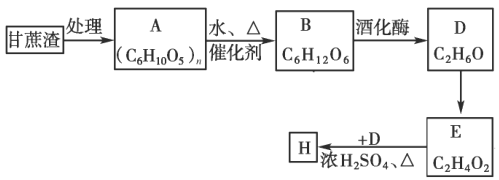
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且能够防止环境污染,现按以下方式进行处理利用:
试回答:
(1)A的名称是____________;
(2)写出D的同分异构体的结构简式____________。
(3)D到E的反应类型为____________,D到E的反应试剂可以为____________。
(4)实验室制备H后,提纯H的分离方法为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备溴苯的实验装置如右图所示,请回答下列问题:
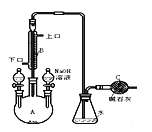
(1)反应开始前已向仪器A中加入的固体药品是铁粉,则装在左侧分液漏斗中的液体药品是 。
(2)写出实验室制溴苯的化学方程式 。
(3)该反应装置中冷凝管B有上、下两个口,冷却水应从 口进入(填“上”或“下”)。
(4)右侧分液漏斗中的物质在 加入A中(填“反应前”、“反应中”或“反应后”),用离子方程式表示其作用是 。
(5)C中碱石灰的作用是 。
(6)该过程可以如下表述:3Br2+2Fe=2FeBr3 ; Br2+FeBr3=FeBr4-+Br+ (不稳定) ;
![]() +Br+→[
+Br+→[![]() ] ; [
] ; [![]() ]+FeBr4-→
]+FeBr4-→![]() +HBr+FeBr3 。
+HBr+FeBr3 。
由上述反应可推知:![]() +Br2 →
+Br2 → ![]() +HBr 中的催化剂为 。(填字母)
+HBr 中的催化剂为 。(填字母)
A. Br2 B.FeBr3 C.Br+ D.FeBr4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
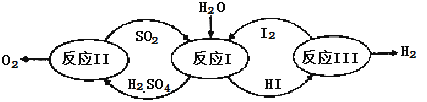
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
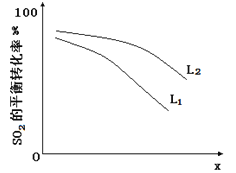
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
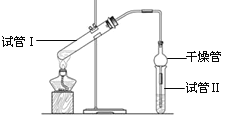
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
① 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
② 分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,
[Cu(OH)4] 2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
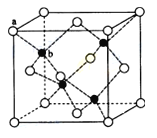
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0pm,密度为________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为______________pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化学基础】有机化合物M是一种香料,工业上用烃A与苯的同系物E为主要原料,按下列路线合成:
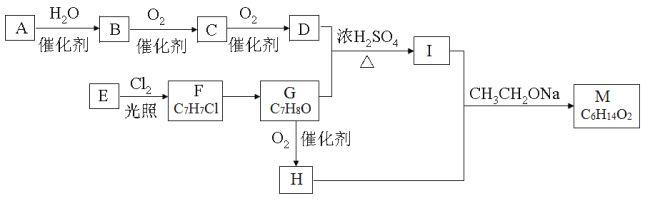
已知:
①RCHO+CH3COOR'![]() RCH=CHCOOR';
RCH=CHCOOR';
②A在标准状况下的密度为1.25g/L。
回答下列问题:
(1)A的名称是_______;H中官能团的名称是 。
(2)E分子中最多有____个原子在同一个平面上;M的结构简式为 。
(3)D+G→I的化学方程式 ,反应类型为_______。
(4)F→G的反应条件是___________;检验C中官能团的试剂是______________。
(5)满足以下条件的I的同分异构体有 种(不考虑立体异构)。
①能与碳酸氢钠溶液反应生成CO2;②苯环上的一氯代物只有两种。
其中核磁共振氢谱为4组峰,且峰面积之比为6∶2∶1∶1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁卡因M [结构简式为![]() ]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
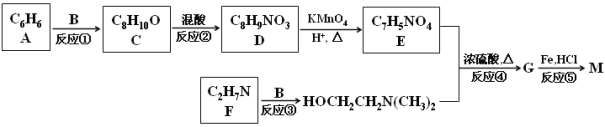
已知:Ⅰ.B和乙醛互为同分异构体,![]() 的结构不稳定;
的结构不稳定;
Ⅱ. ![]() ;
;
Ⅲ. ![]() 。
。
请回答下列问题:
(1)E所含官能团的名称是 ;B的结构简式的 。
(2)比A多两个碳原子,且一氯代物只有3种的A的同系物的名称是 。
(3)下列说法正确的是 。
A.M分子中含有碱性基团氨基,能与盐酸发生反应,临床上常用M的盐酸盐作麻醉剂
B.题中的“混酸”是将浓硫酸缓慢加入浓硝酸中并不断搅拌而得的混合物
C.①、③属于加反应;②、④、⑤属于取代反应
D.反应①原子利用率达100%,生成的C通过加聚反应可直接生成高聚物聚苯乙烯,是一种绿色环保的工艺流程
(4)写出反应④的化学方程式 。
(5)写出一种同时满足下列条件的D的同分异构体的结构简式 。
①能与碳酸氢钠溶液反应 ②含有—NH2 ③苯环上有2种不同环境的氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com