
【题目】普鲁卡因M [结构简式为![]() ]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
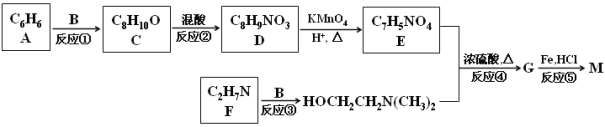
已知:Ⅰ.B和乙醛互为同分异构体,![]() 的结构不稳定;
的结构不稳定;
Ⅱ. ![]() ;
;
Ⅲ. ![]() 。
。
请回答下列问题:
(1)E所含官能团的名称是 ;B的结构简式的 。
(2)比A多两个碳原子,且一氯代物只有3种的A的同系物的名称是 。
(3)下列说法正确的是 。
A.M分子中含有碱性基团氨基,能与盐酸发生反应,临床上常用M的盐酸盐作麻醉剂
B.题中的“混酸”是将浓硫酸缓慢加入浓硝酸中并不断搅拌而得的混合物
C.①、③属于加反应;②、④、⑤属于取代反应
D.反应①原子利用率达100%,生成的C通过加聚反应可直接生成高聚物聚苯乙烯,是一种绿色环保的工艺流程
(4)写出反应④的化学方程式 。
(5)写出一种同时满足下列条件的D的同分异构体的结构简式 。
①能与碳酸氢钠溶液反应 ②含有—NH2 ③苯环上有2种不同环境的氢原子
【答案】
(1)羧基、硝基(2分) ![]() (1分)
(1分)
(2)邻二甲苯(或1,2二甲苯) (1分)
(3)AB (2分)
(4)![]() (2分)
(2分)
(5)![]() (2分,其它合理答案也给分)
(2分,其它合理答案也给分)
【解析】
试题分析:普鲁卡因分子中有苯环结构,A的分子式为C6H6,所以A为苯;B为乙醛的同分异构体,但CH2=CHOH不稳定,则B只能为环氧乙烷![]() ;从A、B、C的分子式分析,C的分子式为A与B的分子式之和,则反应①为苯的取代反应,产物C为C6H5CH2CH2OH;反应②为苯的硝化反应,根据普鲁卡因的结构可知,D的苯环上两取代基处于对位,其结构简式为:
;从A、B、C的分子式分析,C的分子式为A与B的分子式之和,则反应①为苯的取代反应,产物C为C6H5CH2CH2OH;反应②为苯的硝化反应,根据普鲁卡因的结构可知,D的苯环上两取代基处于对位,其结构简式为:![]() ;D被酸性高锰酸钾氧化生成产物E为对硝基苯甲酸:
;D被酸性高锰酸钾氧化生成产物E为对硝基苯甲酸:![]() ;比较反应③的反应物与产物的结构可知F为(CH3)2NH,反应为取代反应;反应④为酯化反应(取代反应),产物G为
;比较反应③的反应物与产物的结构可知F为(CH3)2NH,反应为取代反应;反应④为酯化反应(取代反应),产物G为![]() ;反应⑤为G的还原反应,得产物普鲁卡因M。
;反应⑤为G的还原反应,得产物普鲁卡因M。
(1)从上述分析可知,E为对硝基苯甲酸:![]() ,所含官能团的羧基、硝基;B的结构简式为
,所含官能团的羧基、硝基;B的结构简式为![]() 。
。
(2)比A多两个碳原子的A的同系物,分子式为C8H10,其一氯代物有3种,则该物质为邻二甲苯(或1,2二甲苯)(注意:3种取代产物分别是苯环上取代物2种、甲基上取代物1种)。
(3)A.M分子中的—NH2为碱性基团,能与盐酸发生反应,临床上常用盐酸普鲁卡困作麻醉剂,故A正确;B.“混酸”为浓硫酸与浓硝酸的混合物,由于常用浓硫酸浓度大(约98%),密度大,浓度硝酸浓度相对较小(约69%),密度相对较小,两酸混合时会产生大量的热,所以两酸混合时的操作是将浓硫酸缓慢加入浓硝酸中并不断搅拌,使产物的热量迅速的扩散,故B正确;C.①、②、③、④属于取代反应(有种观点认为反应①和②对于环乙烷来说属于开环加成,这或许是广义的加成反应,但不符合中学化学课本加成反应的定义),⑤属于还原反应(既有“加氢”又有“去氧”),故C不正确;D.C的结构简式为C6H5CH2CH2OH,由C制取聚苯乙烯,需经过消去反应生成苯乙烯,再经加聚反应才能制得,故D不正确。
(4)E为含有羧基,可与![]() 发生酯化反应,反应的化学方程式为:
发生酯化反应,反应的化学方程式为: ![]()
(5)能与碳酸氢钠溶液反应说明结构中有羧基,苯环上有2种不同环境的氢原子,说明苯环上应有两个不同的取代基且处于对位,而D的分子式为C8H9NO3,分子结构中含有—NH2,综合考虑,符合条件的D的同分异构体的结构简式可以写出多种,如 ![]() 、
、![]() 、
、![]() 、
、![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:![]()
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O ![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
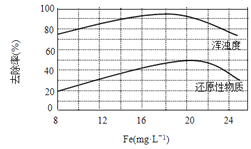
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3物质结构与性质】铬(Cr)位于第四周期ⅥB族,主要化合价:+2、+3、+6,单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子排布图:____________________,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2晶体类型是________,溶剂CCl4、CS2中的碳原子杂化类型分别是___________、_____________。
(2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1 mol 固体可生成2 mol氯化银沉淀。
则这种浅绿色固体中阳离子的化学式:_____________。
(3)某镧(La)铬(Cr)型复合氧化物具有巨磁电阻效应,晶胞结构如图所示:
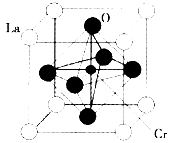
①则其化学式为_________。
②工业上用共沉淀法制备该晶体,以硝酸铬、硝酸镧[La(NO3)3]等金属硝酸盐为原料,以浓氨水为沉淀剂。反应的化学方程式为_________________________________________。
③NH3空间构型为________。
④该晶体中距离氧原子最近的镧原子有________个;若最近的氧原子核间距为a pm,组成物质的摩尔质量为b g·mol-1,阿伏加德罗常数值为NA,则晶体密度的表达式为____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
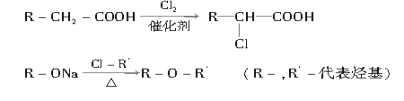
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物。右图为苯氧乙酸的结构简式。
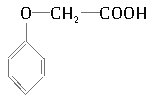
(1)甲一定含有的官能团的名称是___________________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不
含甲基,且为链状结构,其结构简式是______________(碳碳双键上连有羟基的结构不稳定)
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有两种一硝基取代物的同分异构体是(写出任意两种的结构简式)____________________ ________________
(4)已知:
菠萝酯的合成路线如下:
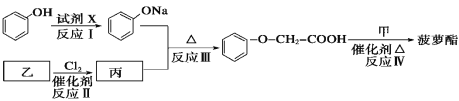
①试剂X不可选用的是(选填字母)________。
a. Na2CO3溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是__________________,反应Ⅱ的反应类型是____________。
③反应Ⅳ的化学方程式是_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学对由某均匀混合的NaHCO3和KHCO3样品进行实验,测得实验如下图所示

已知:Ⅰ.所测气体体积为标准状况
Ⅱ.盐酸的物质的量浓度相等,且体积均是50mL;试计算:
(1)盐酸的物质的量浓度 mol·L-1。
(2)混合物样品中,NaHCO3与KHCO3的物质的量之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】硼与铝为同族元素。据报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录,硼、镁及其化合物在工农业生产中应用广泛;硼酸(H3BO3)是极弱的一元弱酸。硼镁矿主要成分为Mg2B2O5.H2O,用硼镁矿、碳铵法实验室制备硼酸的主要流程如下:
![]()
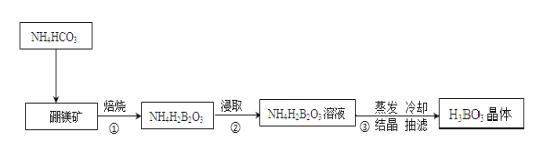
请回答:
(1)步骤①中实验室需要把硼镁矿放在 仪器中焙烧(填实验仪器)。
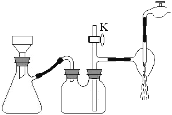
(2)步骤③中采用减压过滤,该小组同学所用的装置如右图所示,若实验过程中发现倒吸现象,应采取最简单的实验操作是 ;从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷却结晶、抽滤、洗涤、干燥获得硼酸晶体,下列实验条件容易使得到的硼酸晶体有较大颗粒的是 。
A.较高温度下快速蒸发
B.用冰水冷却 NH4H2BO3溶液
C.采用较稀的NH4H2BO3溶液
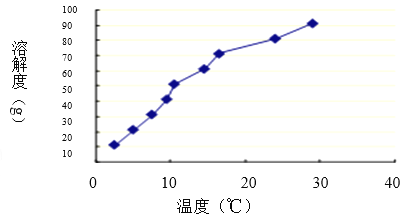
(3)硼酸是极弱的一元弱酸,用离子方程式表示硼酸溶液显酸性的原因 ;硼酸溶解度如下图所示,从操作③中获得H3BO3晶体需要洗涤、干燥,洗涤过程中需要用 (填“冷水”或“热水”),你的理由是 ;
(4)测定硼酸晶体纯度的试验方法是,取0.5000g样品与锥形瓶中,滴加甘油,微热使样品溶解,迅速冷却至室温,滴加指示剂,用NaOH标准溶液滴定至15.80ml时到达终点。已知:每1.00mlNaOH滴定液相当于30.92mg的H3BO3,则该样品中H3BO3的质量分数为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。某课题组模拟地下水脱氮过程,利用如下装置探究Fe粉和KNO3溶液反应及相关因素对脱氮速率的影响。

实验过程如下:
Ⅰ.原料预处理:①先用0.1mol·L-1H2SO4洗涤Fe粉,然后用蒸馏水洗涤至中性;②将0.01mol/L KNO3溶液的pH调至2.5;③打开弹簧夹,缓慢通入N2,并保持后续反应均在N2氛围中进行;
Ⅱ.加入KNO3酸性溶液100mL,一段时间后铁粉部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
Ⅲ.过滤剩余固体时,表面的白色物质变为红褐色;
Ⅳ.检测到滤液中存在NO3-、NH4+、Fe2+。
(1)步骤Ⅰ中用0.1mol L-1H2SO4洗涤Fe粉的目的是 ,通入N2并保持后续反应均在N2氛围中进行的目的是 。
(2)白色物质是 ,用化学方程式解释其变为红褐色的原因: 。
(3)用K3[Fe(CN)6]检验滤液中Fe2+ 的实验方案是 。
(4)取少量滤液,向其中加入几滴KSCN溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色。溶液变成红色的原因是 。
(5)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
①假设一:溶液的pH;假设二:____________________;假设二:____________________;
②设计实验验证上述假设一,请完善实验步骤及结论。(已知:溶液中的NO3-浓度可用离子色谱仪测定)
实验步骤:
ⅰ.分别取 的KNO3溶液于不同的试管中;
ⅱ.调节溶液呈酸性且pH各不相同,并通入N2;
ⅲ.分别向上述溶液中加入足量等质量的同种铁粉;
ⅳ.用离子色谱仪测定相同时间内各溶液中NO3-浓度。
实验结论: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如右图所示:

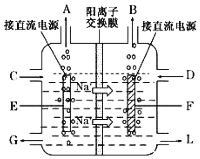
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO![]() 等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+,需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是 ,F电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1 A的直流电理论上可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8 h,制得32%的烧碱溶液(密度为1.342 t/m3)113 m3,电解槽的电流强度1.45 ×104 A,该电解槽的电解效率为 (保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列金属防腐的措施中,① 水中的钢闸门连接电源的负极使用的是 法;
② 地下钢管连接镁块使用的是 法。
(2)NO2、O2和熔融NaNO3可制作燃料电池,其原理见右图,石墨Ⅰ为电池的 极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 。

(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。回答下列问题:

① A极为电池 极,电极反应式为 。

② 若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com