
【题目】【化学——选修3物质结构与性质】铬(Cr)位于第四周期ⅥB族,主要化合价:+2、+3、+6,单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子排布图:____________________,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2晶体类型是________,溶剂CCl4、CS2中的碳原子杂化类型分别是___________、_____________。
(2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1 mol 固体可生成2 mol氯化银沉淀。
则这种浅绿色固体中阳离子的化学式:_____________。
(3)某镧(La)铬(Cr)型复合氧化物具有巨磁电阻效应,晶胞结构如图所示:
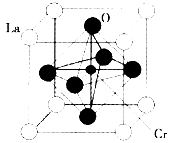
①则其化学式为_________。
②工业上用共沉淀法制备该晶体,以硝酸铬、硝酸镧[La(NO3)3]等金属硝酸盐为原料,以浓氨水为沉淀剂。反应的化学方程式为_________________________________________。
③NH3空间构型为________。
④该晶体中距离氧原子最近的镧原子有________个;若最近的氧原子核间距为a pm,组成物质的摩尔质量为b g·mol-1,阿伏加德罗常数值为NA,则晶体密度的表达式为____________g·cm-3。
【答案】
(1)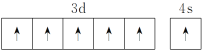 (2分) 分子晶体(1分) sp3、sp(2分)
(2分) 分子晶体(1分) sp3、sp(2分)
(2)[Cr(H2O)5Cl]2+(2分)
(3)①LaCrO3(2分)
②Cr(NO3)3+La(NO3)3+6NH3·H2O=6NH4NO3+ LaCrO3↓+3H2O(2分)
③三角锥形(1分)
④12(1分) (2分)
【解析】
试题分析:
(1)根据物质溶解有机溶剂,可知CrO2Cl2为分子晶体。
(2)由题意知,配离子中有一个Cl-,由其配位数为6,可知中心离子中有5个H2O,外围有2个 Cl-,写出离子化学式。
(4)③N的最外层有5个电子,有3个成键电子对,由价层电子对互斥模型可知为三角锥形;
④从该晶体上平面看氧原子最近距离的镧原子有4个,根据空间有三个相互垂直平面,故该晶体中氧原子最近距离的镧原子12个;
设晶胞的边长为xcm,则由图知其面对角线的长度为xcm,x=2a×10-10cm,所以x= a×10-10cm,由每个晶胞由1个Cr原子、1个La原子和3个O原子构成,即相当有1个LaCrO3,则ρ==。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且能够防止环境污染,现按以下方式进行处理利用:
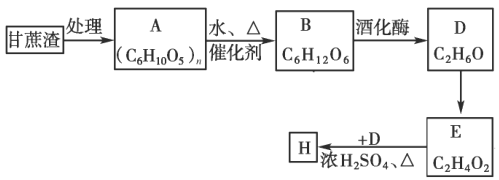
试回答:
(1)A的名称是____________;
(2)写出D的同分异构体的结构简式____________。
(3)D到E的反应类型为____________,D到E的反应试剂可以为____________。
(4)实验室制备H后,提纯H的分离方法为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,
[Cu(OH)4] 2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
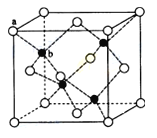
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0pm,密度为________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为______________pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化学基础】有机化合物M是一种香料,工业上用烃A与苯的同系物E为主要原料,按下列路线合成:
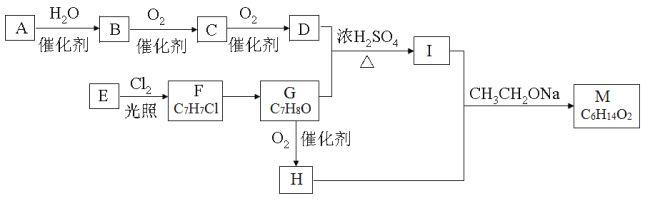
已知:
①RCHO+CH3COOR'![]() RCH=CHCOOR';
RCH=CHCOOR';
②A在标准状况下的密度为1.25g/L。
回答下列问题:
(1)A的名称是_______;H中官能团的名称是 。
(2)E分子中最多有____个原子在同一个平面上;M的结构简式为 。
(3)D+G→I的化学方程式 ,反应类型为_______。
(4)F→G的反应条件是___________;检验C中官能团的试剂是______________。
(5)满足以下条件的I的同分异构体有 种(不考虑立体异构)。
①能与碳酸氢钠溶液反应生成CO2;②苯环上的一氯代物只有两种。
其中核磁共振氢谱为4组峰,且峰面积之比为6∶2∶1∶1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如下图所示。 又知AgCl的Ksp=1.8×10-10。下列说法正确的是( )
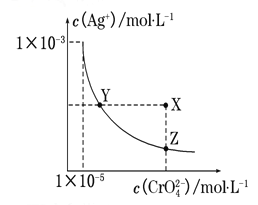
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]辉铜矿主要成分为Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
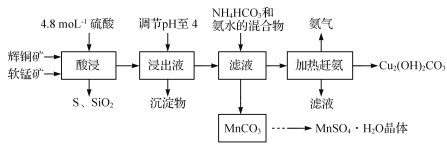
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制250 mL 4.8 mol·L1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要 。
(2)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式: 。
(3)调节浸出液pH=4的作用是 。
(4)本工艺中可循环使用的物质是 (写化学式)。
(5)获得的MnSO4·H2O晶体需要进一步洗涤、干燥,洗涤时应用 洗涤。
(6)测定MnSO4·H2O样品的纯度:准确称取样品14.00 g,加蒸馏水配成100 mL溶液,从中取出25.00 mL用标准的BaCl2溶液测定,完全反应后得到了4.66 g沉淀,则此样品的纯度为__________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲基的电子式 ,氢元素含量最高的烃的分子式______________。
(2)支链只有一个乙基且相对分子质量最小的烷烃的结构简式为
(3)某炔烃经催化加氢后,得到2-甲基丁烷,该炔烃的名称是 (系统命名法命名)
(4)已知某有机物的结构简式为:![]()
①该有机物中所含官能团的名称是________________;_______________。
②写出该有机物使溴水褪色的反应化学方程式_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁卡因M [结构简式为![]() ]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
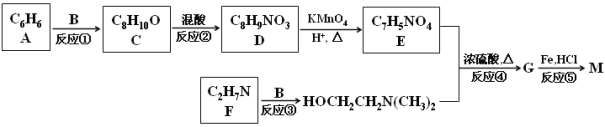
已知:Ⅰ.B和乙醛互为同分异构体,![]() 的结构不稳定;
的结构不稳定;
Ⅱ. ![]() ;
;
Ⅲ. ![]() 。
。
请回答下列问题:
(1)E所含官能团的名称是 ;B的结构简式的 。
(2)比A多两个碳原子,且一氯代物只有3种的A的同系物的名称是 。
(3)下列说法正确的是 。
A.M分子中含有碱性基团氨基,能与盐酸发生反应,临床上常用M的盐酸盐作麻醉剂
B.题中的“混酸”是将浓硫酸缓慢加入浓硝酸中并不断搅拌而得的混合物
C.①、③属于加反应;②、④、⑤属于取代反应
D.反应①原子利用率达100%,生成的C通过加聚反应可直接生成高聚物聚苯乙烯,是一种绿色环保的工艺流程
(4)写出反应④的化学方程式 。
(5)写出一种同时满足下列条件的D的同分异构体的结构简式 。
①能与碳酸氢钠溶液反应 ②含有—NH2 ③苯环上有2种不同环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com