
【题目】下列关于粒子结构的描述不正确的是( )。
A. H2S和NH3均是价电子总数为8的分子
B. HS-和HCl均是含一个极性键的18电子粒子
C. CO2的电子式为![]()
D. 1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机物在生活中无处不在,对人类的生产生活有着重要的作用。
(1)下列物质中不属于有机物的是_____(填字母)。
a.CO2 b.CH4 c.CH3COOH
(2)下列有机物不属于合成高分子的是_____(填字母)。
a.塑料 b.聚乙烯 c.蛋白质
(3)下列物质中不属于糖类的是_____(填字母)。
a.淀粉 b.氨基酸 c.纤维素
(4)下列不属于油脂水解产物的是_____(填字母)。
a.高级脂肪酸 b.甘油(丙三醇) c.乙烯
(5)下列物质中的组成元素与另两种不同的是_____(填字母)。
a.蛋白质 b.糖类 c.油脂
(6)蔗糖的水解产物是_____、_____(填名称),淀粉的化学式为_____。
(7)写出乙烯与溴水反应的化学方程式:_____,该反应类型为_____反应。
(8)乙醇能使酸性KMnO4溶液褪色,这是因为乙醇具有_____性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | |||
3 | ⑦ | ⑧ | ⑨ | |||||
4 | ⑩ |
(1)在这些元素中,化学性质最不活泼的是 ,元素原子半径最小的是 ,被称为“国防金属”的是 ,可作为半导体材料的是 ,单质氧化性最强的元素是 。
(2)元素②的一种同位素(含8个中子)可测定文物年代,这种同位素的符号是 。
(3)在上述元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是 。酸性最强的化合物的化学式是 。
(4)写出③的气态氢化物与其最高价氧化物对应水化物反应的方程式 。
(5)元素④的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)欲从苯酚的乙醇溶液中回收苯酚,有下列操作,合理的顺序是 (填字母)。
①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤通入过量CO2
⑥加入足量NaOH 溶液 ⑦加入足量FeCl3溶液 ⑧加入足量浓溴水
A. ⑧ ② B.⑥ ① ⑤ ③ C.④② D.⑦ ① ③
(2)下列说法正确的是 (填序号)。
①麦芽糖及其水解产物均能发生银镜反应,且试管内壁的银镜需用稀氨水洗涤
②蛋白质溶液中加入饱和硫酸铵溶液,有沉淀析出,加水后沉淀也不溶解
③淀粉液中加入几滴稀硫酸加热几分钟,冷却后加入银氨溶液并水浴加热,没有观察到银镜现象,证明淀粉未发生水解
④只用溴水就能鉴别四氯化碳、甲苯、乙烯、乙醇
Ⅱ已知:CH3CH2OH+NaBr+H2SO4(浓) ![]() CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置如图:圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
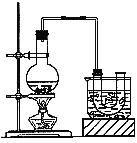
(1)反应时若温度过高会降低溴乙烷的产率,原因是 ;也可看到有红棕色气体产生,该气体的化学式为 。为避免温度过高,宜采用 加热。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去其中的杂质,最好选用下列试剂中的
(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
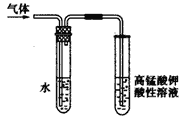
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用右图所示装置进行实验:该实验的目的是 。 盛水的试管(装置)的作用是 。
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后 (填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别写出满足下列叙述中有关物质的结构简式或化学方程式:
(1)能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O是 。
(2)分子式为C3H7Br的卤代烃经消去反应后得到的有机物是 ;
(3)含C、H、O三种元素的有机物,完全燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:1:1,则此类有机物中最简单的一种是 。
(4)苯酚与饱和溴水的反应方程式为 ,该反应用于苯酚的 和 。
(5)TNT(2,4,6-三硝基甲苯)是一种烈性炸药,广泛用于国防、开矿、筑路等,写出制备TNT的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )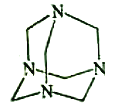
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
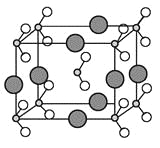
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,科学家们着力研究大气污染物的治理。
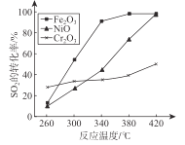
(1)治理含CO、SO2的烟道气以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体。已知:①硫的熔点:112.8℃、沸点:444.6℃;于反应每得到mol硫,放出 270kJ的热量。写出该治理烟道气反应的热化学方程式____________________________________;其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图所示,不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是 ____________________________________;
(2)在450℃,并有V2O5的催化剂存在下SO2能转化为SO3:2SO2(g)+O2 (g)![]() 2SO3(g) △H= -190kJ·mol -1;已知单质硫的燃烧热为296kJ·mol -1,则 S(s)+
2SO3(g) △H= -190kJ·mol -1;已知单质硫的燃烧热为296kJ·mol -1,则 S(s)+![]() O2(g)
O2(g)![]() SO3(g) △H=___kJ·mol -1 。在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2-2n)H2O =2nCuSO4 +(2-2n)H2SO4 从环境保护的角度看,催化脱硫的意义为__________;每吸收标准状况下11.2 LSO2,被SO2还原的O2的质量为__________g。
SO3(g) △H=___kJ·mol -1 。在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2-2n)H2O =2nCuSO4 +(2-2n)H2SO4 从环境保护的角度看,催化脱硫的意义为__________;每吸收标准状况下11.2 LSO2,被SO2还原的O2的质量为__________g。
(3)在一个固定容积为5L的密闭容器中充0.20molSO2和0.10molO2,在450℃并有催化剂条件下,半分钟后达到平衡,测得容器中含SO30.10 mol,则V(O2)=______(mol·L -1·min -1 );放出的热量为______kJ;该温度下的平衡常数为________;若继续通入0.20 molSO2和0.10mol O2,则再次平衡时,二氧化硫的转化率________(选填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:![]()
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O ![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
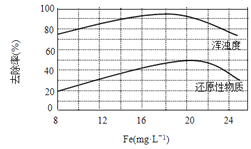
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com