
【题目】乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):

(1)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。用化学平衡理论解释通入水蒸气的原因为 。
(2)从体系自由能变化的角度分析,反应I在____(填“高温”或“低温”)下有利于其自发进行。
(二)制备α-氯乙基苯(原理如反应II所示):

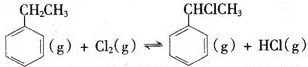
(3)T℃时,向10 L恒容密闭容器中充入2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,5 min时达到平衡,乙苯和Cl2、α-氯乙基苯和HC1的物质的量浓度(c)随时间(t)变化的曲线如图l所示:


①0—5 min内,以HC1表示的该反应速率v(HCl)=____ 。
②T℃时,该反应的平衡常数K=____ 。
③6 min时,改变的外界条件为________。
④10 min时,保持其他条件不变,再向容器中充入1mol乙苯、1 mol Cl2、1 mol α-氯乙基苯 和l mol HCl,12 min时达到新平衡。在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HCl);0—5 min和0—12 min时间段,Cl2的转化率分别用α1、α2 表示,则αl α2(填“>”、“<”或“=”)。
【答案】(1)该反应正向为气体分子数增大的反应,入水蒸气需增大容器容积,减小体系压强,平衡正向移动,增大反应物的转化率。(2)高温(3)①0.032 mol·L-1·min-1 ;②16; ③升高温度
④ ;>
;>
【解析】
试题分析:(1)正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;故答案为:该反应正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
(2)反应I的△S>0,根据ΔG=ΔH-TΔS,该反应在高温下有利于其自发进行,故答案为:高温
(3) ①0—5 min内,以HC1表示的该反应速率v(HCl)=![]() = 0.032 mol·L-1·min-1,故答案为:0.032 mol·L-1·min-1;
= 0.032 mol·L-1·min-1,故答案为:0.032 mol·L-1·min-1;
②T℃时,该反应的平衡常数K=c(α-氯乙基苯)c(HC1)/c(Cl2)c(乙苯)=![]() =16,故答案为:16;
=16,故答案为:16;
③6 min时,平衡向右移动,反应物核外生成物的浓度没有发生突变,根据该反应正反应为吸热反应,因此改变的外界条件为升高温度,故答案为:升高温度;
④10 min时,保持其他条件不变,再向容器中充入1mol乙苯、1 mol Cl2、1 mol α-氯乙基苯 和l mol HCl,12 min时,四种物质的浓度分别变为c(α-氯乙基苯)=0.28mol/L,c(HC1) =0.28mol/L,c(Cl2) =0.12mol/L,c(乙苯) =0.12mol/L,假设反应的C12的浓度为x
开始(mol/L)0.12 0.12 0.28 028
反应 x x x x
平衡 0.12-x 0.12-x 0.28+x 0.28+x
则![]() =16,解得x=0.04,10-12 min,Cl2和HCl的浓度变化曲线为
=16,解得x=0.04,10-12 min,Cl2和HCl的浓度变化曲线为 ,0—5 min,Cl2的转化率α1=
,0—5 min,Cl2的转化率α1=![]() ×100%=80%,0—12 min时间段,Cl2的转化率α2=
×100%=80%,0—12 min时间段,Cl2的转化率α2=![]() ×100%=73%,则αl>α2,故答案为:
×100%=73%,则αl>α2,故答案为: ;>。
;>。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b连接时,铜片上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
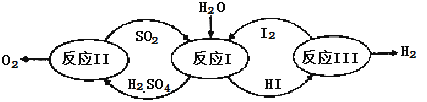
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是 。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
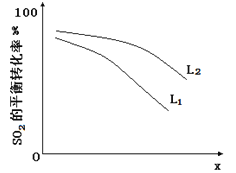
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,
[Cu(OH)4] 2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
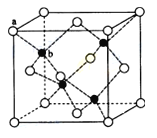
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0pm,密度为________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为______________pm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)下图是实验室用氢气还原氧化铜实验的简易装置。其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中。
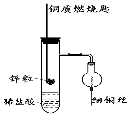

(1)铜质燃烧匙的作用有 , 。
(2)实验过程中,在试管M中可观察到的现象是 , 。
(二)原电池与电解池在化学工业中有广泛应用。如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
(1)若断开k1,闭合k2,则装置为_____ ;X电极上的电极反应式为_____________;电解质溶液中的阳离子向______极移动(填X或Y);
(2)若线路中通过3.01×1022的电子,则Y极上析出物质的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化学基础】有机化合物M是一种香料,工业上用烃A与苯的同系物E为主要原料,按下列路线合成:
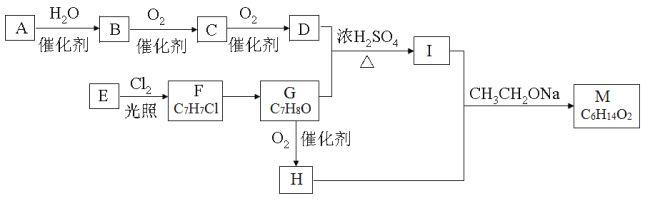
已知:
①RCHO+CH3COOR'![]() RCH=CHCOOR';
RCH=CHCOOR';
②A在标准状况下的密度为1.25g/L。
回答下列问题:
(1)A的名称是_______;H中官能团的名称是 。
(2)E分子中最多有____个原子在同一个平面上;M的结构简式为 。
(3)D+G→I的化学方程式 ,反应类型为_______。
(4)F→G的反应条件是___________;检验C中官能团的试剂是______________。
(5)满足以下条件的I的同分异构体有 种(不考虑立体异构)。
①能与碳酸氢钠溶液反应生成CO2;②苯环上的一氯代物只有两种。
其中核磁共振氢谱为4组峰,且峰面积之比为6∶2∶1∶1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如下图所示。 又知AgCl的Ksp=1.8×10-10。下列说法正确的是( )
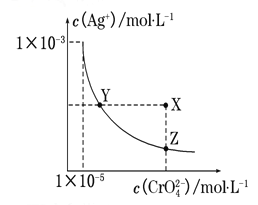
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲基的电子式 ,氢元素含量最高的烃的分子式______________。
(2)支链只有一个乙基且相对分子质量最小的烷烃的结构简式为
(3)某炔烃经催化加氢后,得到2-甲基丁烷,该炔烃的名称是 (系统命名法命名)
(4)已知某有机物的结构简式为:![]()
①该有机物中所含官能团的名称是________________;_______________。
②写出该有机物使溴水褪色的反应化学方程式_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的物理性质见附表)。
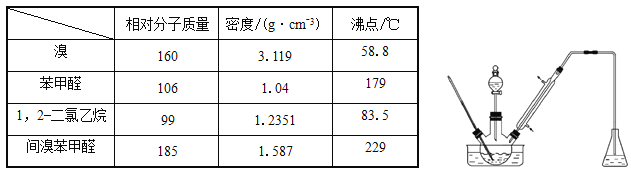
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水硫酸钙固体,放置一段时间后过滤。
步骤4:为了防止间溴苯甲醛因温度过高被氧化,把步骤3处理得到的间溴苯甲醛加入少量锌粉,同时采用某种技术,收集相应馏分,其中收集到间溴苯甲醛为3.7g 。
(1)实验装置中采用的加热方式为_______,冷凝管的作用为_______,锥形瓶中的试剂应为________。
(2)步骤1所加入的无水AlCl3的作用为_________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式)。
(4)步骤3中加入的无水硫酸钙固体的目的是_______________。
(5)步骤4中,某种技术为__________________。
(6)本实验所得到的间溴苯甲醛产率是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com