
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
【答案】(1)防止FeSO4被氧气氧化;除去铁屑表面的油污(2)n(CO2)= n(MnCO3)=0.01 mol
n(EDTA)=0.0014mol
10 mL溶液中 n(Mn2+)=0.0014mol
7.390 g 该碱式碳酸锰中n(Mn2+)=0.07mol,n[Mn(OH)2]=0.06 mol
m(H2O)=0.9 g ,nH2O)=0.05 mol
a∶b∶c= 1∶6∶5
碱式碳酸锰的化学式为MnCO3·6Mn(OH)2·5H2O
【解析】
试题分析:(1)硫酸亚铁易被氧化,需要加入铁粉防止硫酸亚铁被氧化,用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是防止FeSO4被氧气氧化,反应前需将废铁屑用热Na2CO3溶液浸泡是利用碳酸钠溶液的碱性除去铁表面的油污;
(2)n(CO2)=n(MnCO3)=0.01 mol,n(EDTA)=0.0014mol
10 mL溶液中 n(EDTA)=n(Mn2+)=0.028L×0.0500molL﹣1=0.0014mol
500mL溶液n(Mn2+)=0.0014mol×![]() =0.07mol
=0.07mol
7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol
n[Mn(OH)2]=0.06 mol
m(H2O)=7.390g﹣0.01mol×115g/mol﹣0.06mol×204g/mol=0.9 g
n(H2O)=![]() =0.05 mol
=0.05 mol
a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O,
故答案为:n(CO2)=n(MnCO3)=0.01 mol n(EDTA)=0.0014mol
10 mL溶液中 n(EDTA)=n(Mn2+)=0.028L×0.0500molL﹣1=0.0014mol
500mL溶液n(Mn2+)=0.0014mol×![]() =0.07mol
=0.07mol
7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol
n[Mn(OH)2]=0.06 mol
m(H2O)=7.390g﹣0.01mol×115g/mol﹣0.06mol×204g/mol=0.9 g
n(H2O)=![]() =0.05 mol
=0.05 mol
a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O


科目:高中化学 来源: 题型:
【题目】“保护环境,就是保护人类自己”。下列环境问题与其产生的主要原因不相符有几个?( )
①“光化学烟雾”主要是由NOx等引起的
②“白色污染”主要是由聚乙烯塑料等引起的
③“温室效应”主要是由空气中CO2浓度增大引起的
④“臭氧空洞”主要是大量使用氟氯代烃等引起的
⑤“赤潮”主要是由水体中P、N等元素过量引起的
⑥“酸雨”主要是由空气中SO2、NOx、CO2浓度增大引起的
⑦“PM2.5”主要由化石燃料的燃烧(如机动车尾气、燃煤)等引起的
A.0个B.1个C.2个D.3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大。五种元素中,仅R为金属元素,其原子序数为27。X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个。
根据判断出的元素回答下列问题:

(1)基态R原子核外电子排布式为 。
(2)1mol配合物[R(XY)6]4-中含有σ键的数目为 。
(3)XZW2是一种高毒类物质,结构与甲醛相似,X原子杂化方式为 ,其沸点高于甲醛的主要原因是 。
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为 (用文字描述)。
(5)R与某元素A构成的晶体的晶胞结构如下图所示,则R的配位数是 ,A的配位数是 。
(6)在答卷的图中画出与顶点m配位的所有A原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别写出满足下列叙述中有关物质的结构简式或化学方程式:
(1)能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O是 。
(2)分子式为C3H7Br的卤代烃经消去反应后得到的有机物是 ;
(3)含C、H、O三种元素的有机物,完全燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:1:1,则此类有机物中最简单的一种是 。
(4)苯酚与饱和溴水的反应方程式为 ,该反应用于苯酚的 和 。
(5)TNT(2,4,6-三硝基甲苯)是一种烈性炸药,广泛用于国防、开矿、筑路等,写出制备TNT的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻苯二甲酸二乙酯![]() 是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法:
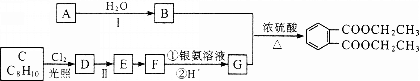
已知以下信息:
①有机化合物A可用来催熟水果。
②机化合物C的核磁共振氢谱显示其有3种不同化学环境的氢原子。
![]()
(1)A的结构简式是 ,B的名称为 。
(2)反应Ⅱ的试剂是 ,该反应类型为 。
(3)C生成D的化学方程式为 。
(4)G和B的化学方程式为 。
(5)在G的同分异构体中,
A.能与新制的Cu(OH)2悬浊液在加热条件下反应生成砖红色沉淀
B.能与碳酸钠反应生成二氧化碳
C.能使FeCl3溶液显色
满足上述三个条件的同分异构体有 种,写出符合上述条件的物质可能的结构简式(只写三种) ,所有这些同分异构体中,有 种化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
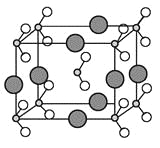
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到 平衡时碘化氢的转化率和氢气的物质的量浓度。2HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如右图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
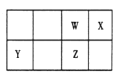
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
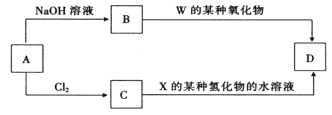
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是
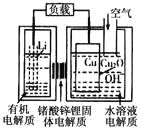
A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,正极的电极反应式为O2+2H2O+4e-==4OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com