
【题目】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因CO![]() 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO![]() 第一步水解的离子方程式:_________________________________________________________________。
第一步水解的离子方程式:_________________________________________________________________。
已知25 ℃时,CO![]() 第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=20∶1时,溶液的pH=________。
)=20∶1时,溶液的pH=________。
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式: _____________________________________________________________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1 CH3COONa溶液,则两份溶液中c(NO![]() )、c(NO
)、c(NO![]() ) 和c(CH3COO-)由大到小的顺序为____________________,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________。
) 和c(CH3COO-)由大到小的顺序为____________________,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
【答案】CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH- 9 3HCO
+OH- 9 3HCO![]() +Al3+===Al(OH)3↓+3CO2↑ c(NO
+Al3+===Al(OH)3↓+3CO2↑ c(NO![]() )>c(NO
)>c(NO![]() )>c(CH3COO-) AD
)>c(CH3COO-) AD
【解析】
(1)①CO![]() 第一步水解生成碳酸氢根离子、氢氧根离子;
第一步水解生成碳酸氢根离子、氢氧根离子;
CO![]() 第一步水解的平衡常数Kh=
第一步水解的平衡常数Kh=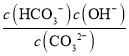 ;
;
②NaHCO3和Al2(SO4)3溶液混合,发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(2) HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1,酸性HNO2 >CH3COOH,所以CH3COO-水解程度大于NO![]() 。等浓度的CH3COONa溶液的pH大于NaNO2,要使pH相等,可以降低CH3COONa溶液的pH或升高NaNO2溶液的pH;
。等浓度的CH3COONa溶液的pH大于NaNO2,要使pH相等,可以降低CH3COONa溶液的pH或升高NaNO2溶液的pH;
(1)①CO![]() 第一步水解生成碳酸氢根离子、氢氧根离子,水解的离子方程式为CO
第一步水解生成碳酸氢根离子、氢氧根离子,水解的离子方程式为CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-;
+OH-;
CO![]() 第一步水解的平衡常数Kh=
第一步水解的平衡常数Kh=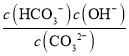 =2×10-4 mol·L-1,当溶液中c(HCO
=2×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=20∶1时,
)=20∶1时,![]() 2×10-4 mol·L-
2×10-4 mol·L-![]() 10-5 mol·L-1,溶液的pH=9;
10-5 mol·L-1,溶液的pH=9;
②NaHCO3溶液和Al2(SO4)3溶液混合,发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式是3HCO![]() +Al3+===Al(OH)3↓+3CO2↑;
+Al3+===Al(OH)3↓+3CO2↑;
(2) 根据方程式2NO2+2NaOH===NaNO3+NaNO2+H2O,含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应生成0.1mol NaNO2、0.1mol NaNO3, 溶液体积为1L,则NaNO2、NaNO3的浓度均为0.1mol/L;HNO3是强酸,NaNO3不水解, HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1,酸性HNO2 >CH3COOH,所以CH3COO-水解程度大于NO![]() ,所以两份溶液中c(NO
,所以两份溶液中c(NO![]() )、c(NO
)、c(NO![]() ) 和c(CH3COO-)由大到小的顺序为c(NO
) 和c(CH3COO-)由大到小的顺序为c(NO![]() )>c(NO
)>c(NO![]() )>c(CH3COO-);
)>c(CH3COO-);
A.向溶液A中加适量NaOH,A的pH升高,能使两溶液pH相等,故选A;
B.向溶液A中加适量水,A的pH降低,不能使两溶液pH相等,故不选B;
C.向溶液B中加适量NaOH,B的pH升高,不能使两溶液pH相等,故不选C;
D.向溶液B中加适量水,B的pH降低,能使两溶液pH相等,故选D;
选AD。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,它可由咖啡酸合成,其合成过程如下。下列说法不正确的是
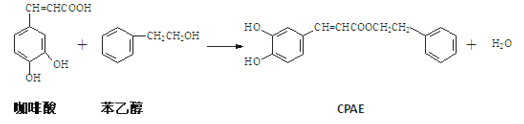
A. 咖啡酸的分子式为C9H8O4
B. 咖啡酸可发生加聚反应,并且所得聚合分子中含有3种官能团
C. 1 mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH
D. 1 mol CPAE与足量H2反应,最多消耗7 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水溶液中的离子平衡问题叙述正确的是
A.将10mL0.1mol·L-1盐酸加入到10mL0.1mol·L-1碳酸钠溶液中:c(Na+)>c(Cl-)>c(HCO![]() )>c(CO
)>c(CO![]() )
)
B.某温度下0.1mol·L-1的醋酸pH为3,加水稀释10倍,则稀释后的溶液pH等于4
C.0.02mol·L-1HCN溶液与0.02mol·L-1NaCN溶液等体积混合c(HCN)+c(CN-)=0.04mol·L-1
D.向0.01mol·L-1醋酸溶液中加水,稀释后溶液中![]() 比值增大(忽略稀释过程中溶液温度变化)
比值增大(忽略稀释过程中溶液温度变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种活泼金属。从高钛渣(主要为TiO2)提炼海绵钛流程如下:
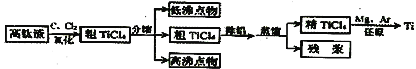
氯化后的粗TiCl4中含有FeCl3、SiCl4、AlCl3等杂质,相关物质的沸点如下表:
化合物 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
沸点/℃ | 136 | 310 | 56.5 | 180 |
下列说法不正确的是( )
A.“氯化”反应的尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是H2O、FeCl2溶液、NaOH溶液
B.“分馏”得到的低沸点物为SiCl4,高沸点物为FeCl3
C.己知“除铝”的方法是用水湿润的活性炭加入到粗TiCl4,目的是将AlCl3转化为Al(OH)3而除去
D.“还原”过程中还原剂可以选择金属钠,气氛可以选择N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电镀废水含A阴离子,排放前的处理过程如下:
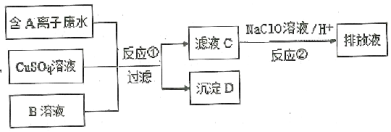
己知:4.5g沉淀D在氧气中灼烧后,产生4.0g黑色固体,生成的无色无味气体通过足量澄清石灰水时,产生5.0g白色沉淀,最后得到的混合气体除去氧气后,还剩余标准状况下密度为1.25g·L-1的单质气体E 560mL。
(1)E的结构式为____________。
(2)写出沉淀D在氧气中灼烧发生的化学方程式_______________________________。
(3)溶液B具有性质____________(填“氧化性”或“还原性”)。
(4)滤液C中还含有微量的A离子,通过反应②,可将其转化为对环境无害的物质,用离子方程式表示该反应为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 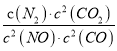 ,请写出此反应的热化学方程式___________________。
,请写出此反应的热化学方程式___________________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
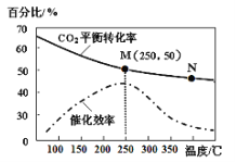
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
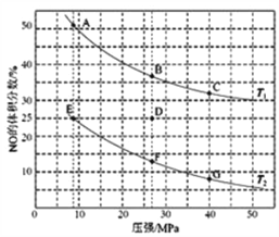
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 溶液滴定
溶液滴定![]() 溶液,曲线如图所示。下列说法错误的是
溶液,曲线如图所示。下列说法错误的是
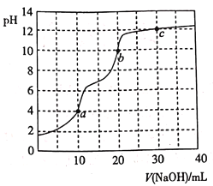
A.滴定终点a可选择甲基橙作指示剂
B.c点溶液中![]()
C.b点溶液中![]()
D.a、b、c三点中水的电离程度最大的是c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为1L的密闭容器中发生某化学反应:2A(g)![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
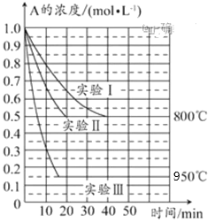
(1)在实验Ⅰ中,反应在20~40min内A的平均反应速率为__mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是___。
(2)该反应的ΔH___0,其判断理由是___。
(3)实验Ⅰ第40min末,若降低反应温度,达到新的平衡后,A的浓度不可能为___(填序号)。
A.0.35mol·L-1 B.0.4mol·L-1 C.0.7mol·L-1 D.0.8mol·L-1
(4)若反应在800℃进行,在该1L的密闭容器中加入1molA、0.2molHe,达到平衡时A的转化率应___。
A.等于86% B.等于50% C.小于50% D.介于50%~86%之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
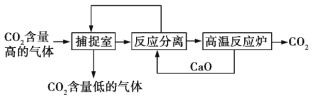
下列有关该方法的叙述中正确的是
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,“捕捉”到的CO2还可用来制备甲醇等产品
A.①③B.②④C.③④D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com