
【题目】在一个体积为1L的密闭容器中发生某化学反应:2A(g)![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
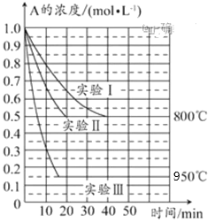
(1)在实验Ⅰ中,反应在20~40min内A的平均反应速率为__mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是___。
(2)该反应的ΔH___0,其判断理由是___。
(3)实验Ⅰ第40min末,若降低反应温度,达到新的平衡后,A的浓度不可能为___(填序号)。
A.0.35mol·L-1 B.0.4mol·L-1 C.0.7mol·L-1 D.0.8mol·L-1
(4)若反应在800℃进行,在该1L的密闭容器中加入1molA、0.2molHe,达到平衡时A的转化率应___。
A.等于86% B.等于50% C.小于50% D.介于50%~86%之间
【答案】0.0075 实验Ⅱ使用了催化剂 > 根据实验Ⅲ和实验Ⅰ的比较,可推知升高温度,平衡正向移动,该反应为吸热反应 AB D
【解析】
(1)实验Ⅰ中,反应在20min至40min内A的浓度变化为0.55mol/L-0.4mol/L=0.15mol/L,再根据υ=c÷t计算;实验Ⅱ和实验I相比,A的起始浓度相同,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快;
(2)实验Ⅲ和实验Ⅰ的比较,升高温度,平衡时A的浓度减小,平衡向正反应移动;
(3)降低温度,平衡逆向移动,A的浓度增大;
(4)恒容充惰性气体,对原平衡不产生影响。
(1)实验Ⅰ中,反应在20min至40min内A的浓度变化为0.55mol/L0.4mol/L=0.15mol/L,所以υ(A)=0.15mol/L÷20min=0.0075molL1min1;
实验Ⅱ和实验I相比,A的起始浓度相同,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强虽然平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂。
故答案为:0.0075;实验Ⅱ使用了催化剂;
(2)实验Ⅲ和实验Ⅰ的比较,升高温度,平衡时A的浓度减小,平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故△H>0,
故答案为:>;根据实验Ⅲ和实验Ⅰ的比较,可推知升高温度,平衡正向移动,该反应为吸热反应;
(3)降低温度,平衡逆向移动,A的浓度增大,故A的浓度大于0.4molL1,
故答案为:AB;
(4)恒容充惰性气体,对原平衡不产生影响,故平衡时A的浓度为0.4molL1,故A的转化率为(1mol/L0.4mol/L)÷1mol/L×100%=60%,
故答案为:D。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体4.48L(气体体积均在标准状况下测定,下同),这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL。下列说法不正确的是![]()
![]()
A.此反应过程中转移的电子为0.6mol
B.消耗氧气的体积是1.68L
C.混合气体中含NO23.36L
D.参加反应的硝酸是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因CO![]() 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO![]() 第一步水解的离子方程式:_________________________________________________________________。
第一步水解的离子方程式:_________________________________________________________________。
已知25 ℃时,CO![]() 第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=20∶1时,溶液的pH=________。
)=20∶1时,溶液的pH=________。
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式: _____________________________________________________________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1 CH3COONa溶液,则两份溶液中c(NO![]() )、c(NO
)、c(NO![]() ) 和c(CH3COO-)由大到小的顺序为____________________,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________。
) 和c(CH3COO-)由大到小的顺序为____________________,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是

A. 稀Ba(OH)2溶液的浓度为0.1molL-1
B. C点溶液的PH=a
C. D点溶液中C(OH-)<C(H+)+C(CH2COOH)
D. E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
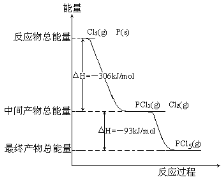
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式___。
(2)PCl5分解成PCl3和Cl2的热化学方程式___。
(3)P和Cl2分两步反应生成1molPCl5的△H3=__,P和Cl2一步反应生成1molPCl5的△H4___△H3 (填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,已知反应前后各元素化合价不变,其化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
(1)已知在25℃、101kPa时,16g N2H4在氧气中完全燃烧生成氮气,放出312kJ的热量,则N2H4完全燃烧的热化学方程式是_______________。
Ⅱ.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)—空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
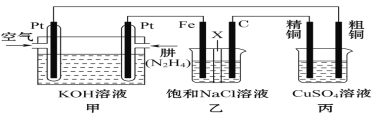
根据要求回答相关问题:
(2)甲装置中通入_________气体的一极为正极,负极的电极反应式为__________。
(3)乙装置中石墨电极为______极,其电极反应式为___________;可以用______________检验该反应产物,电解一段时间后,乙池中的溶液呈__________性。
(4)图中用丙装置模拟工业中的_____________________原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为____________g。
(5)如果将丙中的粗铜电极换为Pt电极,则丙中总化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
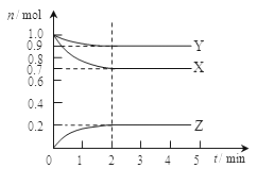
(1)该反应的化学方程式为:______________________________。
(2)反应开始至2min,用Z表示的平均反应速率为:_______________。
(3)下列叙述能说明上述反应达到化学平衡状态的是_________(填序号)。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2 mol Z
D.混合气体的总质量不随时间的变化而变化
E.恒定容积,混合气体的密度不再发生改变
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g)![]() 2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
①升高温度,反应速率_____________;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com