
����Ŀ����¯ˮ���Ȼή��ȼ�ϵ������ʡ�Ӱ���¯��ʹ����������������ɰ�ȫ������
![]() ij��¯ˮ������Ҫ�ɷ���
ij��¯ˮ������Ҫ�ɷ���![]() ��
��![]() ��
��![]() ��
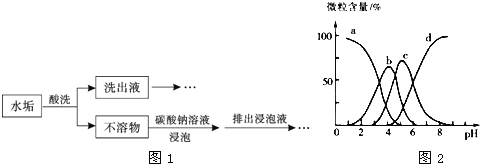
��![]() ������ϴ���ɳ�ȥ��ˮ���������ԭ����ͼ1��ʾ��
������ϴ���ɳ�ȥ��ˮ���������ԭ����ͼ1��ʾ��
![]() ��ϴʱ��Ϊʹˮ���������ܽ⣬����ѡ�õ��� ______
��ϴʱ��Ϊʹˮ���������ܽ⣬����ѡ�õ��� ______ ![]() ����
����![]() ��
��
A.ϡ����![]() ����
����![]() ����
����![]() ����
����
![]() ��������̼������Һ����ʱ����Ӧ�����ӷ���ʽ�� ______ ��
��������̼������Һ����ʱ����Ӧ�����ӷ���ʽ�� ______ ��
![]() ϴ��Һ�е�
ϴ��Һ�е�![]() �ḯʴ���ʹܵ�����Ӧ�����ӷ���ʽ�� ______ ����ˣ�����ϴ��Һ�м������ǿ��ԭ�Ե�
�ḯʴ���ʹܵ�����Ӧ�����ӷ���ʽ�� ______ ����ˣ�����ϴ��Һ�м������ǿ��ԭ�Ե�![]() ��Һ����Ӧ�е�
��Һ����Ӧ�е�![]() ��
��![]() �����ʵ���֮��Ϊ1��2��
�����ʵ���֮��Ϊ1��2��![]() ת��Ϊ
ת��Ϊ![]() ______
______ ![]() �����ӷ���
�����ӷ���![]() ��
��
![]() ������
������![]() ��
��![]() ��ʾ
��ʾ![]() ��������ϴ������Һ��
��������ϴ������Һ��![]() ��
��![]() ��
��![]() ��
��![]() �ĺ�����pH�Ĺ�ϵ��ͼ2��ʾ��ͼ��a���������������İٷֺ�������ҺpH�ĸı���仯��ԭ���� ______
�ĺ�����pH�Ĺ�ϵ��ͼ2��ʾ��ͼ��a���������������İٷֺ�������ҺpH�ĸı���仯��ԭ���� ______ ![]() ������������Һ��
������������Һ��![]() �������ڳ�ȥˮ���е���������
�������ڳ�ȥˮ���е���������![]() ʱ����Һ������4�������������� ______ ��
ʱ����Һ������4�������������� ______ ��
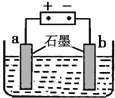
![]() ������ͼ��ʾװ�öԹ�¯ˮ
������ͼ��ʾװ�öԹ�¯ˮ![]() ��
��![]() ��
��![]() ��
��![]() ����Ԥ����������Ч��ֹ��¯ˮ�����γɣ��������У�
����Ԥ����������Ч��ֹ��¯ˮ�����γɣ��������У�![]() ��
��![]() �� ______
�� ______ ![]() ����a������b��
����a������b��![]() �������γɳ�����
�������γɳ�����
���𰸡�A ![]()
![]()
![]() ����ҺpH����ƽ��
����ҺpH����ƽ�� ![]() �����ƶ������ԣ�
�����ƶ������ԣ�![]() �İٷֺ�����С
�İٷֺ�����С ![]() b
b
��������
(1)��ϡ�����������������ƣ�����ڷ�Ӧ��ı��棬�ݴ˽��
�ڳ����������������ת�������ƣ��ݴ˽��
�����ݷ�Ӧԭ��д�����ӷ�Ӧ����ʽ������������ԭ��Ӧ�жϲ��
������ƽ���ƶ�ԭ���жϼ��ɣ����������Ϣ�жϺ����������ӣ�
(2)���ݵ��ˮԭ���������ɡ�
![]() ��ʹ��ϡ�����������������ƣ�����ڷ�Ӧ��ı��棬ʹ��Ӧ�ﲻ����ȫ��Ӧ�ʲ���ѡ���ᣬ�ʴ�Ϊ��A��
��ʹ��ϡ�����������������ƣ�����ڷ�Ӧ��ı��棬ʹ��Ӧ�ﲻ����ȫ��Ӧ�ʲ���ѡ���ᣬ�ʴ�Ϊ��A��
![]() ��ˮ�������ữ֮��ֻ��������Dz��������̼���ƣ��������ܽ�ȸ�С��̼��ƣ���Ӧ�����ӷ���ʽ��
��ˮ�������ữ֮��ֻ��������Dz��������̼���ƣ��������ܽ�ȸ�С��̼��ƣ���Ӧ�����ӷ���ʽ��![]() ��
��
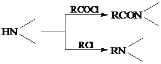
![]() ���������Կ�������л�ԭ�Ե�����Ӧ�����������ӣ��ḯʴ���ʹܵ����ݵ�ʧ����������ȵ�ԭ����Ħ�������������ӣ�����������ӣ����������ӷ�ӦʽΪ
���������Կ�������л�ԭ�Ե�����Ӧ�����������ӣ��ḯʴ���ʹܵ����ݵ�ʧ����������ȵ�ԭ����Ħ�������������ӣ�����������ӣ����������ӷ�ӦʽΪ![]() ���ܹ��õ���Ħ���ĵ��ӣ�����һĦ��
���ܹ��õ���Ħ���ĵ��ӣ�����һĦ��![]() ת��Ϊ
ת��Ϊ![]() ��
��
![]() ����PHֵ������������Ũ�Ȼ��С��ƽ�������ƶ�������
����PHֵ������������Ũ�Ȼ��С��ƽ�������ƶ�������![]() ��������٣�
��������٣�![]() ��
��![]() ��
��![]() ��
��![]() ��ͼ���б�ʾ�����߷ֱ�Ϊa��b��c��d���Դ�ͼ���Ͽ���B��ʽ��ߵ����Ժ���������
��ͼ���б�ʾ�����߷ֱ�Ϊa��b��c��d���Դ�ͼ���Ͽ���B��ʽ��ߵ����Ժ���������![]() ��
��
![]() ����¯ˮʵ���Ͼ��ǵ��ˮ��ˮ��������������������ŵ磬����������������Ũ��ƫ�����¯ˮ�еĸ�þ�������ɳ��������Դ���������ļ�����������b���������ɳ������ʴ�Ϊ��b��
����¯ˮʵ���Ͼ��ǵ��ˮ��ˮ��������������������ŵ磬����������������Ũ��ƫ�����¯ˮ�еĸ�þ�������ɳ��������Դ���������ļ�����������b���������ɳ������ʴ�Ϊ��b��


 ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ�����û������ϳɻ���ϩ�ķ�Ӧʵ��װ����ͼ��ʾ��
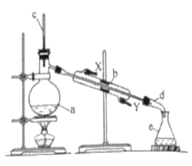
�����õ����й��������£�

��1������a������Ϊ_____��������a�м���ٻ�������Ũ��������Ƭ�ĺ���˳��Ϊ_____������ţ������Ƭ��������_____��
��2��װ��b������ˮӦ��_____�ڽ��룻�÷�Ӧ�¶ȼƵ���ֵ���Ʋ�����90�棬�¶ȼ�ˮ�������֧�ܿڴ���Ŀ����____��
��3���ɻ�������ȡ����ϩ�ķ���ʽ_____��ʵ���������ײ����ĸ�����Ľṹ��ʽΪ____��
��4�������ᴿʱ�������ɴֲ�Ʒ�����Һ©���зֱ�������5%̼������Һ��ˮϴ�ӣ�������ټ�����ˮ�Ȼ��ƿ�������Һ©����ʹ��ǰ����ϴ�ɾ���_____�����Һ©���дֲ�Ʒ����5%̼������Һ��ķ������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2(g)+B2(g)=2AB(g)��H=+100kJ/mol�������仯��ͼ��ʾ���ж�������������ȷ����
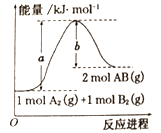
A. ����������÷�Ӧ�ķ�Ӧ����H����С
B. ÿ����2molA-B����������bkJ����
C. ÿ����2����AB����(a-b)kJ����
D. �÷�Ӧ����Ӧ�Ļ�ܴ���100kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��ԭ���������ε�����ǰ������Ԫ�ء�A�������к�����ḻ��Ԫ�أ�D��Eͬ���壬��E��ԭ��������D������;B��D��ɵĻ�������һ����������;CԪ��ԭ�������P�ܼ���S�ܼ���1������;Fԭ�ӵ�������������A��ͬ�����������������ݴ˻ش��������⡣
��1��FԪ���γɵĸۻ�̬���ӵĺ�������Ų�ʽΪ__________��
��2��E��һ�־���ǿ��ԭ�Ե���������ӵ�VSEPRģ��Ϊ__________��
��3��C��D��EԪ�صĵ�һ�������ɴ�С��˳����__________������Ԫ�ط��ű�ʾ��
��4��A��D�γɵ�18���ӻ�����������BE2����������__________���˻����ﻹ�ɽ����Թ�ҵ��ˮ�е�CN-����Ϊ̼���κͰ�����Ӧ�����ӷ���ʽΪ__________
��5��C�ж�����������м���Է���������С����һ�������£�2L��������0��5L�������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵĺ������εĻ�ѧʽ��__________��
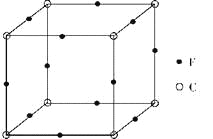
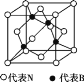
��6��F��C�γɻ�����ľ�����ͼ��ʾ���û�����Ļ�ѧʽΪ_____________��C���ӵ���λ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
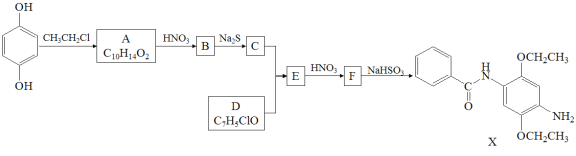
����Ŀ��ij�о�С����ϳ�Ⱦ��X��ҽҩ�м���Y��
��֪�� ��
��![]()
��ش�
(1)����˵����ȷ����____________��
A��������A����FeCl3��Һ������ɫ��Ӧ B��������C����������
C��������F�ܷ����ӳɡ�ȡ������ԭ��Ӧ D��X�ķ���ʽ��C17H22N2O3
(2)������B�Ľṹ��ʽ��___________________________________________________��
(3)д��C+D��E�Ļ�ѧ����ʽ_____________________________________________________��
(4)д��������A(C10H14O2)ͬʱ��������������ͬ���칹��Ľṹ��ʽ_____________________________��
1H��NMR��IR���������ٷ�������4�ֻ�ѧ������ͬ����ԭ�ӣ��ڷ����к��б�����������(��OCH3)��û���ǻ���������(��O��O��)��
(5)�����CH2=CH2��![]() Ϊԭ���Ʊ�Y(
Ϊԭ���Ʊ�Y(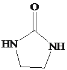 )�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)
)�ĺϳ�·��(������ͼ��ʾ�����Լ���ѡ)
_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K4[Fe(CN)6]������ʳ�εĿ������������K4[Fe(CN)6]��ֽ�����(CN)2��KCN��N2��Fe3C��C�����ʡ�
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ___�������������漰�ļ���Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ___��[Fe(CN)6]4-�У����ṩ�Ŀչ����Ŀ��___��
��2��(CN)2�����д���̼̼������(CN)2�����幹����__��������������������Ŀ֮��Ϊ___��KCN���������ÿ��γ�HCN��HCN������ԭ�ӵ��ӻ��������Ϊ___��
��3����֪Fe3C�ľ����ṹ��̼ԭ�ӵ���λ��Ϊ6����̼ԭ�ӽ��ڵ���ԭ�ӵĿռ乹��Ϊ___����ԭ�ӵ���λ����___��
��4��̼Ԫ�ؿ��γɶ��ֽṹ�����ʲ�ͬ�ĵ��ʣ����н��ʯ���۵�Ϊ3550�棬C60���۵�ԼΪ280�棬�������ֲ����ԭ����___��
��5��������λ��ͬһ�壬��NiO�����������������AΪ(0��0��0)��BΪ(1��1��0)����C�����������Ϊ___��һ���¶��£�NiO��������Է��ط�ɢ���γ��������Ӳ�����������ΪO2-�����õ������У�Ni2+�������(��ͼ2)����֪O2-�İ뾶Ϊam��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ___g��(��a��NA��ʾ)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��(N2H4)��ǿ�������������ⳣ�������ȼ��,������ֹ��������ѺϽ���ϡ���ش���������:
��1��N2H4��H2O2�����Ԫ���е�һ������������______��
��2����Ԫ�ػ�̬ԭ�ӵĺ�������Ų�ʽΪ_____________________��
��3��1 mol N2H4�������������Լ�����ĿΪ___________��
��4��H2O2�����ֽ�ΪH2O,H2O�Ŀռ乹��Ϊ_______,������ԭ�ӵ��ӻ��������Ϊ_________��
��5��H2S��H2O2����Ҫ�����������±���ʾ:
���� | �۵�/K | �е�/K | ˮ���ܽ��(��״��) |
H2S | 187 | 202 | ÿ��ˮ���ܽ�2.6 L |
H2O2 | 272 | 423 | ������Ȼ��� |
��������۷е���ܽ�Ȳ������Ҫԭ��ֱ���_______________��________________��
��6������þ�͵���������������زյ������β���,������:����þ_______(����ڡ���С�ڡ�)�����ơ�
��7������������ľ�����ͼ��ʾ�����ھ��������ԭ�ӵ���λ��Ϊ______���������߳�Ϊa cm,��������������ܶ���________________g��cm-3��(ֻҪ���г���ʽ,�谢���ӵ�������ֵΪNA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����л���E��ֱ���ͷ���G�ڹ��������·�Ӧ�������������ͷ���L��ֱ���ͷ���M(���G���ӵ�Ԫ��Ϊ�������ڵ�Ԫ��)������ͼ���������ж���������
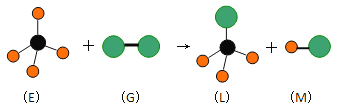
A. ���³�ѹ�£�E��һ����ɫ��ζ������
B. ������Ӧ�����Ǽӳɷ�Ӧ
C. �ڹ�������L���� G�����������������Ƶķ�Ӧ
D. ������Ӧ������ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�ĵ���ƽ���У�c(H��)�� c(OH��)�Ĺ�ϵ��ͼ��ʾ��
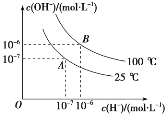
(1)100 ��ʱ������ˮ�еμ����ᣬ___(������������������)ʹ��ϵ���� B ��״̬��
(2)25 ��ʱ���� pH��9 �� NaOH ��Һ�� pH��4 ��������Һ��ϣ����û����Һ�� pH��7���� NaOH ��Һ��������Һ�������Ϊ___��
(3)100 ��ʱ����������c(H��)��5��10��5 mol��L��1������ˮ��������� c(H��)��____��
������֪�� 25 ��ʱ�����ᡢ�����ᡢ̼���������ĵ���ƽ�ⳣ���ֱ�Ϊ����K��1.75��10-5�������� K��2.95��10-8��̼�� K1��4.30��10-7 ��K2��5.61��10-11��������K1��1.54��10-2��K2��1.02��10-7
(4)д��̼��ĵ�һ������ƽ�ⳣ������ʽK1��___��
(5)����ͬ�����£���Ũ�ȵ� CH3COONa��NaClO��Na2CO3��NaHCO3��Na2SO3 �� NaHSO3 ��Һ�м�����ǿ����_____����Ũ�ȵ� Na2CO3 �� NaHCO3 �Ļ����Һ�и�����Ũ�ȴ�С˳��Ϊ______��
(6)�������¶Ȳ��䣬�ڴ�����Һ��ͨ������ HCl(g)�����������С����_____(����ĸ��ţ���ͬ)��
a��c(CH3COO-) b��c(H+) c������ĵ���ƽ�ⳣ�� d��c(CH3COOH)
(7)�������ӷ���ʽ�д������_____��
a ���� CO2 ͨ�����������Һ�У�CO2��H2O��ClO��=HCO![]() ��HClO
��HClO
b ���� SO2 ͨ����������Һ�У�Ca2+��2ClO����SO2��H2O=CaSO3����2HClO
c ���� CO2 ͨ�����ʯ��ˮ�У�CO2��OH��=HCO![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com