
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
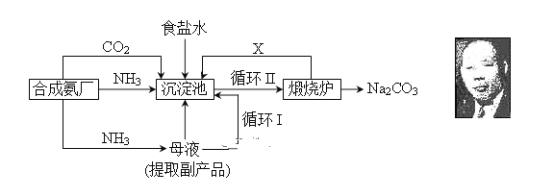
(1) 上述生产纯碱的方法称________________,副产品的一种用途为____________。
(2) 沉淀池中发生的化学反应方程式是____________________________________。
(3) 写出上述流程中X物质的分子式________________。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________________________________________________________。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_________。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
【答案】联合制碱法或侯德榜制碱法化肥或电解液或制药等(其他合理答案均给分)NH3 + CO2 + H2O + NaCl = NH4Cl + NaHCO3↓或NH3 + CO2 + H2O = NH4HCO3, NH4HCO3 + NaCl = NaHCO3↓ + NH4ClCO2I过滤过量稀硝酸和硝酸银溶液a、c
【解析】
根据联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3 + CO2 + H2O + NaCl = NH4Cl + NaHCO3↓;
主要的副产物为氯化铵,需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法,检验氯离子的方法为用硝酸酸化的硝酸银来检验,若出现氯化银沉淀则说明有氯离子存在等知识点来解题。
(1)目前工业制碱方法有二:氨碱法和联合制碱法。题中方法由我们侯德榜所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3 + CO2 + H2O + NaCl = NH4Cl + NaHCO3↓,得到一摩尔的碳酸氢钠同时得到一摩尔的氯化铵,故副产物为氯化铵,氯化铵可用来制作化肥,
故答案为:联合制碱法,做化肥;
(2)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3 + CO2 + H2O + NaCl = NH4Cl + NaHCO3↓,
故答案为:NH3 + CO2 + H2O + NaCl = NH4Cl + NaHCO3↓;
(3)在联合制碱法中二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,
故答案为:CO2;
(4)循环Ⅰ是将未反应的氯化钠返回沉淀池中,从固液混合物中分离出固体的方法为过滤。
故答案为:Ⅰ;过滤;
(5)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,
故答案为:过量稀硝酸和硝酸银溶液;
(6)向母液中通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。
故答案为:a、c。


科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃.完全燃烧时产生的水和二氧化碳的物质的量之比为1:1.A的相对分子质量小于30.在下图变化中,中间产物C能和新制的氢氧化铜反应生成砖红色沉淀.(反应条件未写出)
又知2CH3CHO+O2![]() 2CH3COOH.请回答下列问题:
2CH3COOH.请回答下列问题:
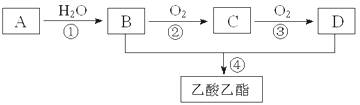
(1)写出A的电子式________
(2)B、D分子内含有的官能团分别是________、________(填名称);
(3)判断下列反应的反应类型:①______________,③______________
(4)写出下列反应的化学方程式:②________________________________________;
(5)下列说法正确的是________。
A.有机物B与金属钠反应,现象是钠浮在液面,不停的游动,最后消失。
B.有机物B、D以及乙酸乙酯可用饱和Na2CO3溶液鉴别
C.反应④中,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由12CO和14CO组成的混合气体对氦气的相对密度为7.125,则混合气体中12C和14C的原子个数比为( )
A. 1∶1 B. 1∶2 C. 3∶1 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1mol/LNa2CO3溶液:c(OH-)=c(H2CO3)+c(HCO3-)+c(H+)
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1-10的元素中,满足上述关系的元素共有
A. 2组 B. 4组 C. 5组 D. 6组
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
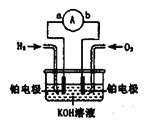
(1)氢氧燃料电池的能量转化形式主要是_______,在导线中电子流动方向为_____(用a、b和箭头表示)。
(2)负极反应式为__________。
(3)电极表面镀铂粉的原因为__________ 。
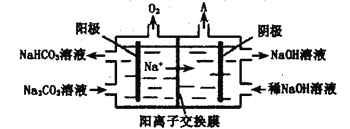
(4)使用上述电池电解(均为Pt电极)一定浓度的Na2CO3溶液,原理如下图所示。阳极的电极反应式为___________。
(5)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解泄中隔膜可阻止气体通过,阴、阳极均为惰性电极)。
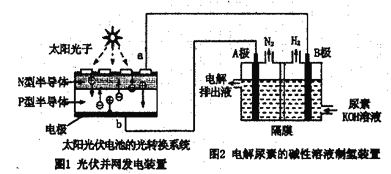
①图1中N型半导体为________(填“正极”或“负极”)。该系统工作时,A极的电极反应式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,若A极产生7.00gN2,则此时B极产生_____LH2(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
2N0+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : l 的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 ℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭器中,发生反应:I2(g)+H2(g)![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=______ mol·L-1,而c(HI)=________,所以化学反应速率________最大。(填v(正)或v(逆))。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)_____,而c(HI)_____ ,从而化学反应速率v(正) _______ (填减小、增大、不变)。
(3)当反应进行到v(正)与v(逆)________时,此可逆反应达到了最大限度。若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率都将________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com