
【题目】[化学—选修3:物质结构与性质]A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 ,超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2 ②HO2在碱中不能稳定存在
③氧化产物是HO2 ④1 mol Z参加反应有1 mol电子发生转移
(5)ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。
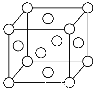
(6)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。
【答案】(1)非极性 2
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑ 原子 分子间形成氢键
(3)O>N>Al (4)1s22s22p63s23p63d104s1;③
(5)正四面体 sp3
(6)![]() (2分)
(2分)
【解析】试题分析:A元素可形成自然界硬度最大的单质,该单质为金刚石,则A为C元素;B与A同周期,核外有三个未成对电子,则B为N元素;根据X原子的第一电离能至第四电离可知,X原子的第四电离能剧增,则X表现+3价,所以X为Al元素;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质,则Y为S元素;Z的一种同位素的质量数为63、中子数为34,则质子数=63-34=29,故Z为Cu元素;
(1)AY2化学式是CS2,其结构式为S=C=S,为直线型结构,属于非极性分子,其分子中每个双键中含有1个σ键,所以CS2分子存在2个σ键;
(2)X是Al元素,铝与NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑(或2Al+2OH-+6H2O=2Al(OH)4+3H2);XB是CN,晶体与金刚石类似,属于原子晶体;B的最简单氢化物是NH3,N原子电负性大,分子间形成氢键,所以容易液化;
(3)非金属性越强,电负性越强,Al、O、N元素的电负性与非金属性一致,则三种元素电负性大到小顺序为:O>N>Al;
(4)Z为29号Cu元素,根据构造原理,其基态原子核外电子排布式为:[Ar]3d104s1或1s22s23S23p63d104s1;①O2中氧元素的化合价是0价,HO2中氧元素的化合价是-0.5价,化合价降低作氧化剂,故①正确;②HO2为超氧酸,应具有酸性,可与碱反应,故HO2在碱中不能稳定存在,故②正确;③还原产物是HO2,故③错误;④1molCu参加反应生成+1价铜离子,有1mol电子发生转移,故④正确,根据以上分析可知,不正确的为③;
(5)SO42-离子的中心原子S的价层电子对为(6+2)/2=4,孤电子对数为![]() =0,故其空间结构为正四面体,S原子杂化方式为:sp3;
=0,故其空间结构为正四面体,S原子杂化方式为:sp3;
(6)Z为Cu元素,铜原子位于顶点和面心,每个晶胞中含有铜原子的数目为:8×1/8+6×1/2=4,晶胞中含有4个铜原子,则晶胞的质量为:(64×4)/NAg,设该晶胞的边长为xcm,则该晶胞体积为:x3cm3,其密度为:ρ=![]() =9.00g/cm3,整理可得x=
=9.00g/cm3,整理可得x=![]() 。
。


科目:高中化学 来源: 题型:
【题目】右图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO32-+7H2O
D.电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯含有少量固体杂质NaCl的KNO3,正确的实验操作是( )
A.溶解,过滤
B.溶解,蒸发浓缩,冷却结晶,过滤
C.溶解,蒸发结晶
D.溶解,萃取,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl﹣浓度最大的是
A.200mL 2mol/L MgCl2溶液
B.1000mL 2.5mol/L NaCl溶液
C.10g AgCl固体加入 300mL水充分搅拌
D.250mL 1mol/L AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中,正确的是( )
A. 钠在空气中燃烧只生成白色的氧化钠固体
B. 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
C. 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作
D. 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1
2NO2(g)![]() N2O4(g) △H=-52.7kJ·mol-1
N2O4(g) △H=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________。
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为: 。
Ⅱ、(1)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
测得平衡时数据如下:
平衡时物质的量(mol) | n(NO) | n(H2O) |
温度T1 | 1.6 | 2.4 |
温度T2 | 1.2 | 1.8 |
在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)= 。
②温度T1和T2的大小关系是T1 T2(填“>”、 “<”或“=”)。
(2)电解KOH溶液,如果某段时间内氢氧储罐中共收集到33.6L气体已折算成标况),则该段时间内水电解系统中转移电子的物质的量为__________mol。
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:![]() =O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
=O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葡萄糖的说法中,错误的是( )
A.葡萄糖的分子式是C6H12O6
B.葡萄糖是多羟基醛,因而具有醛和多元醇的性质
C.葡萄糖是最简单的醛糖
D.葡萄糖可以通过绿色植物光合作用合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中。
(1)Na2S2O5中硫元素的化合价是________,焦亚硫酸钠在空气中久置会与氧气反应生成连二硫酸钠 (Na2S2O6), 写出该反应的化学方程式,并标出该反应电子的转移方向和数目_________________;
(2)葡萄酒中的 Na2S2O5的使用量是以游离的 SO2 来计算的,SO2 的摩尔质量________。我国规定每升葡萄酒中SO2的最高含量是 0.25g,则一瓶 800mL 的葡萄酒中 SO2的物质的量不能超过___________(精确到 0.001 );
(3)世界卫生组织规定按照体重计算,每人每天摄入SO2的最大量应控制在 0.7mg/kg,如果一个人体重是60kg,那么他每天喝上述葡萄酒的量不超过 __________mL 就不会造成健康上的问题。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com