
【题目】短周期元素的离子:![]() 具有相同的电子层结构,下列关系中不正确的是( )
具有相同的电子层结构,下列关系中不正确的是( )
A. 质子数:![]() B. 还原性:
B. 还原性:![]()
C. 氧化性:![]() D. 半径:
D. 半径:![]()
【答案】A
【解析】
短周期元素的离子:![]() 具有相同的电子层结构,则一定满足a-3=b-1=c+2=d+1,其中W和Y属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。
具有相同的电子层结构,则一定满足a-3=b-1=c+2=d+1,其中W和Y属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。
A.根据a-3=b-1=c+2=d+1,所以质子数:![]() ,故选A;
,故选A;
B.同周期自左向右原子半径逐渐减小,非金属性逐渐增强,非金属性越强,相应阴离子的还原性就越弱,还原性:![]() ,故不选B;
,故不选B;
C.同周期自左向右原子半径逐渐减小,金属性逐渐减弱,金属性越强,离子氧化性越弱,氧化性:![]() ,故不选C;
,故不选C;
D.当电子层结构相同时,核电荷数越大,吸电子能力越强,半径越小,半径:![]() ,故不选D;
,故不选D;
答案:A


科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A. SO2的浓度为0.4 mol·L-1,O2的浓度为0.2 mol·L-1
B. SO2的浓度为0.25 mol·L-1
C. SO3的浓度为0.4 mol·L-1
D. SO2、SO3的浓度均为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,有A、B两个容器,A是恒容密闭容器,B是恒压密闭容器。两容器起始状态完全相同,其中都充有NO2气体,如果只考虑发生下列可逆反应:2NO2![]() N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
N2O4,分别经过一段时间后,A、B都达平衡,下列有关叙述正确的是
A. 平均反应速率A>B
B. 平衡时NO2的物质的量B>A
C. 平衡时NO2的转化率A>B
D. 平衡时N2O4的物质的量B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.  图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.  图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.  图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 
 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是空气中含量最多的元素,在自然界中的分布十分广泛,在生物体内亦有极大作用。一定条件下,含氮元素的物质可发生如图所示的循环转化。回答下列问题:
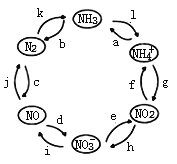
(1)氮分子的电子式为______________________。
(2)图中属于“氮的固定”的是___________(填字母)。
(3)已知NH4Cl溶液呈酸性,用离子方程式解释原因___________________________________________ 。
(4)用离子方程式举一例表示循环中发生非氧化还原反应的过程__________________。
(5)若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂物质的量之比为____________。
(6)若反应i是在酸性条件下由NO3—与Fe2+的作用实现,则该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A. Si、P、S的第一电离能随原子序数的增大而增大
B. 价电子排布为3d64s2的元素位于第四周期第ⅧB族,是d区元素
C. 2p和3p轨道形状均为哑铃形,能量不相等
D. 氮原子的最外层电子排布图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
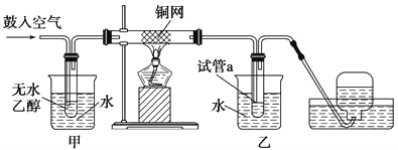
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式__________________ 、_____________________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是____________ 反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如图所示。
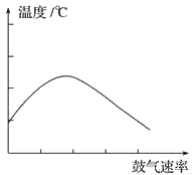
试解释出现图中现象的原因_______________________。
(3)甲和乙两个水浴作用不相同。甲的作用是_______________;乙的作用是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______。要除去该物质,可在混合液中加入________ (填写字母)。然后,再通过________________(填实验操作名称)即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com