
下列事实不能作为实验判断依据的是( )
| A.钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱 |
| B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 |
| C.硫酸和硅酸钠溶液反应出白色沉淀,判断硫与硅的非金属活动性强弱 |
| D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
B
解析试题分析:A.比较金属活动性强弱的依据是根据金属与水发生反应置换出氢的难易。Na和容易与水发生反应。而Mg不易与冷水发生反应。因此可以判断钠和镁的金属活动性强弱。错误。B.在MgCl2与AlCl3溶液中分别加入过量的氨水,都会发生反应产生白色沉淀Mg(OH)2、Al(OH)3.虽然Al(OH)3是两性氢氧化物,能与强酸、强碱发生反应,但是一水合氨是弱碱,不能反应。因此不能判断镁与铝的金属活动性强弱。正确 。C .元素的非金属性越强,其最高价的含氧酸的酸性就越强。根据复分解反应发生的规律:强酸制取弱酸。由于发生H2SO4+Na2SiO3=Na2SO4+ H2SiO3↓。所以酸性H2SO4>H2SiO3。因此判断硫与硅的非金属活动性强弱。错误。D.Br2+H2 2HBr;I2+H2
2HBr;I2+H2 2HI.元素的单质与氢气化合越容易,其非金属性就越强。因此判断溴与碘的非金属活动性强弱。错误。
2HI.元素的单质与氢气化合越容易,其非金属性就越强。因此判断溴与碘的非金属活动性强弱。错误。
考点:考查判断元素的金属性、非金属活动性强弱的方法的知识。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:单选题
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法不正确的是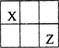
| A.原子半径:Y>Z>W |
| B.一定条件下,Y可置换出X |
| C.气态氢化物稳定性:Z>W |
| D.熔点YW2>XW4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
几种短周期元素的原子半径及主要化合价如下表: 
下列叙述正确的是 ( )
| A.X、Y元素的金属性 X<Y |
| B.一定条件下,Z单质与W的常见单质直接生成ZW2 |
| C.Y的最高价氧化物对应的水化物能溶于氨水 |
| D.Z的气态氢化物与其最高价氧化物对应的水化物可以反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关元素的性质及其递变规律正确的是
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
| A.X的最高化合价为+4 |
| B.X是第二周期VA族元素 |
| C.X是第二周VIA族元素 |
| D.X的最高价含氧酸的分子式可表示为H3XO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于3 2He的说法正确的是
| A.3 2He原子核内含有2个中子 | B.3 2He原子核内含有3个质子 |
| C.3 2He原子核外有3个电子 | D.3 2He和4 2He是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关原子结构及元素周期律的叙述正确的是
| A.同主族元素的原子最外层电子数相同,化学性质也相同 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X
位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是( )
| A.原子半径X<Y |
| B.最高价氧化物对应的水化物酸性X>Y |
| C.X的氢化物具有强还原性 |
| D.Y与碘同周期,Y的最高价氧化物对应的水化物的酸性比高碘酸(HIO4)强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com