
下列有关元素的性质及其递变规律正确的是
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
科目:高中化学 来源: 题型:单选题
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是
| | | R | | |
| T | Q | | W | G |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质性质的比较,正确的是
| A.热稳定性:HF<HCl<HBr | B.微粒半径: O2->Mg2+>Cl- |
| C.第一电离能:Si>Al>Mg | D.电负性:Si>Al>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能作为实验判断依据的是( )
| A.钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱 |
| B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 |
| C.硫酸和硅酸钠溶液反应出白色沉淀,判断硫与硅的非金属活动性强弱 |
| D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.0.1mol/LNa2CO3溶液35℃时的碱性比25℃时强,说明盐类水解反应是放热反应 |
| B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br 、I的非金属性递增的规律 |
C.2SO2(g)+O2(g)  2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 2SO3(g) △H<0,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 |
| D.室温下,同浓度的Na2CO3溶液的pH比 Na2SiO3溶液的pH小,说明非金属性C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是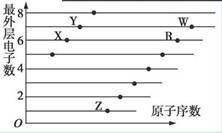
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:X>Y |
| D.X、Z形成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )
| A.K是银白色金属,硬度大,熔点高 |
| B.K在空气可以被空气中的氧气所氧化,且产物只有K2O |
| C.K与水能够反应,但不如Na与水的反应剧烈,产物都有氢气 |
| D.K也可以与氯气反应,且比Na与氯气的反应剧烈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com