
【题目】下列元素的最高价氧化物对应的水化物中碱性最强的是
A. AlB. LiC. NaD. Mg
科目:高中化学 来源: 题型:
【题目】用系统命名法给下列有机物命名或写出对应的结构简式。
(1) _________。
_________。
(2) _________。
_________。
(3)3甲基2戊稀__________________。
(4)1,3,5三甲苯__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应:N2+3H2![]() 2NH3。下列关于该反应的说法正确的是 ( )
2NH3。下列关于该反应的说法正确的是 ( )
A. 最终可生成0.2 mol NH3
B. 压缩体积,增大压强能使反应速率减小
C. 降低反应体系的温度能加快反应速率
D. 容器体积不变,向容器中再加入N2,能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。
⑴CaSO4·2H2O脱水反应相关的热化学方程式为:
CaSO4·2H2O(s)=CaSO4·![]() H2O(s)+
H2O(s)+![]() H2O(g) ΔH1=83.2 kJ·mol-1
H2O(g) ΔH1=83.2 kJ·mol-1
CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1
H2O (g)=H2O(l) ΔH3=-44 kJ·mol-1
则反应CaSO4·![]() H2O(s)=CaSO4(s)+
H2O(s)=CaSO4(s)+ ![]() H2O(g)的ΔH4=_________kJ·mol-1。
H2O(g)的ΔH4=_________kJ·mol-1。
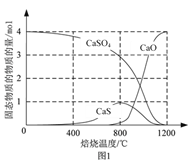
⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
①以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如图1所示。在低于800 ℃时主要还原产物为___________;高于800 ℃时主要发生的反应的化学方程式为___________。
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如下图2所示。CaCl2的作用是___________;当温度高于1200 ℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是___________。

③以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100 ℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是___________。
⑶利用反应CaSO4(s)+(NH4)2CO3(aq)![]() CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=___________。(已知Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某链烃3.6g和Cl2发生取代反应,控制反应条件使其仅生成一氯代物,将反应生成的气体(一氯代物为液体)用NaOH溶液吸收恰好和0.1molL-1NaOH溶液500mL完全反应,试解答下列问题:
(1)求该烃的相对分子质量_______________;
(2)若该烃既不能使酸性KMnO4溶液褪色,又不能使溴水褪色,试求该烃的分子式____________。
(3)若该烃的一氯代物只有一种,试确定该烃的结构简式(要求写出计算过程)_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制物质的量浓度溶液时,其它操作都正确,下列操作对所得溶液浓度有偏高影响的是( )
A. 称量时砖码生锈 B. 溶解前烧杯内有水
C. 容量瓶洗涤后未干澡 D. 定容时仰视容量瓶刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com