
【题目】用系统命名法给下列有机物命名或写出对应的结构简式。
(1) _________。
_________。
(2) _________。
_________。
(3)3甲基2戊稀__________________。
(4)1,3,5三甲苯__________________。
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:
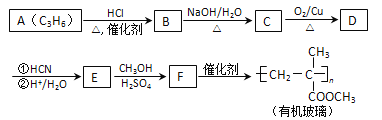
已知以下信息:
①核磁共振氢谱表明D只有一种化学环境的氢;
②羰基化合物可发生以下反应: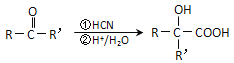 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)
③E在甲醇、硫酸的作用下,发生酯化、脱水反应生成F。
回答下列问题:
(1)A的结构简式为_____,A生成B的反应类型为_______。
(2)B生成C的化学方程式为_______。
(3)D的结构简式为_____,分子中最多有 __________个原子共平面。
(4)F的化学名称为_______。
(5)F的同分异构体中能同时满足下列条件的共有 ______种(不含立体异构);其中核磁共振氢谱显示为4组峰,且峰面积比为3 : 2 : 2 : 1的是_____; (写出其中一种的结构简式)。
①能与饱和NaHCO3溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
(6)聚乳酸(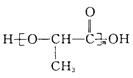 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
I.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
反应物 | 催化剂 | 温度 | |
① | 10mL10% H2O2溶液 | 无 | 25℃ |
② | 10mL20% H2O2溶液 | 无 | 25℃ |
③ | 10mL20% H2O2溶液 | 无 | 40℃ |
④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |
通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:

(1)代表实验①的图示是________________。
(2)对比实验③和④的目的是_____________。
(3)通过上面对比实验,所得的实验结论是_______。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3 mol H2,一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),测得其中N2物质的量随时间变化如图所示。回答下列问题:
2NH3(g),测得其中N2物质的量随时间变化如图所示。回答下列问题:

(4)从开始反应到t2时刻,氨气的平均反应速率为_____________。
(5)在t3时刻,氢气的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。

(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为 。
(5)反应开始至2分钟时,B的平均反应速率为 。
(6)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲制取较纯净的1,2二氯乙烷,可采取的方法是( )
A.乙烯与HCl加成
B.乙烯与Cl2加成
C.乙烷与Cl2按1:2的体积比在光照条件下反应
D.乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2,Na2CO3
C.NaOH,Na2CO3 D.Na2O2,NaOH,Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 是短周期界元素中的四种非金属元素,它们的原子序数依次增大,
是短周期界元素中的四种非金属元素,它们的原子序数依次增大,![]() 元素的原子形成的离子就是一个质子,
元素的原子形成的离子就是一个质子,![]() 、
、![]() 在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,
在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,![]() 原子的最外层电子数是内层电子数的2倍。
原子的最外层电子数是内层电子数的2倍。
1.请写出![]() 在元素周期表中的位置为第________周期、第________族。
在元素周期表中的位置为第________周期、第________族。
2.气体分子![]() 的电子式为________________
的电子式为________________
3.由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素可组成酸式盐,该化合物的水溶液与足量
四种元素可组成酸式盐,该化合物的水溶液与足量![]() 溶液在加热条件下反应的离子方程式为_________________。
溶液在加热条件下反应的离子方程式为_________________。
4.在一定条件下,由![]() 单质与单质可化合生成
单质与单质可化合生成![]() ,工业上用
,工业上用![]() 检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质
检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质![]() 生成,写出化学方程式__________________________________。该反应中被氧化的
生成,写出化学方程式__________________________________。该反应中被氧化的![]() 与参与反应的
与参与反应的![]() 的质量之比____________。
的质量之比____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X(C4H6O5)广泛存在于许多水果内。该化合物具有如下性质:①1molX与足量金属钠反应产生1.5mol气体;②在有浓硫酸和加热条件下,X与醇或羧酸均反应生成有香味的产物;根据上述信息,对X的结构判断正确的是
A. 含有碳碳双键 B. 含有两个羧基和一个羟基
C. 含有一个羧基和两个羟基 D. 含有三个羟基和一个﹣COOR
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com