
ЎҫМвДҝЎҝДі»ҜС§ҝОНв»о¶ҜРЎЧйОӘБЛСйЦӨФӘЛШ»ҜС§РФЦКөЭұд№жВЙЈ¬ҪшРРИзПВКөСйМҪҫҝЎЈМҪҫҝЈәСйЦӨВИФӘЛШөД·ЗҪрКфРФұИБтФӘЛШөД·ЗҪрКфРФЗҝЈ¬ЙијЖИзПВКөСйЈә

ЈЁ1Ј©Ч°ЦГAЦРКў·ЕөДКФјБКЗ___ЈЁМоСЎПоЈ©Ј¬AЦР·ўЙъ·ҙУҰөД»ҜС§·ҙУҰ·ҪіМКҪКЗ___ЎЈ
aЈ®Na2SO3ИЬТә bЈ®Na2SИЬТә cЈ®Na2SO4ИЬТә
ЈЁ2Ј©ПВБРІ»ДЬУГУЪСйЦӨВИФӘЛШұИБтФӘЛШ·ЗҪрКфРФЗҝөДТАҫЭОӘ__ЈЁМоСЎПоЈ©ЎЈ
aЈ®HClұИH2SОИ¶Ё
bЈ®HClOСх»ҜРФұИH2SO4Зҝ
cЈ®HClO4ЛбРФұИH2SO4Зҝ
dЈ®МъУлCl2·ҙУҰЙъіЙFeCl3Ј¬¶шБтУлМъ·ҙУҰЙъіЙFeS
ЈЁ3Ј©ИфТӘСйЦӨ·ЗҪрКфРФЈәCl>IЈ¬Ч°ЦГAЦРјУИлөн·Ыөв»ҜјШ»мәПИЬТәЈ¬№ЫІмөҪЧ°ЦГAЦРИЬТә__өДПЦПуЈ¬јҙҝЙЦӨГчЎЈУГФӯЧУҪб№№АнВЫҪвКН·ЗҪрКфРФCl>IөДФӯТтЈәН¬ЦчЧеФӘЛШҙУЙПөҪПВЈ¬__ЎЈ
Ўҫҙр°ёЎҝb Cl2+Na2S=2NaCl+SЎэ b ұдА¶ ФӯЧУ°лҫ¶өЭФцЈ¬өГөзЧУДЬБҰөЭјх
ЎҫҪвОцЎҝ
ФӘЛШөД·ЗҪрКфРФФҪЗҝЈ¬¶ФУҰөДөҘЦКөДСх»ҜРФФҪЗҝЈ¬ҝЙНЁ№эөҘЦКЦ®јдөДЦГ»»·ҙУҰЕР¶ПЈ¬ФӘЛШөД·ЗҪрКфРФФҪЗҝЈ¬¶ФУҰөДЗв»ҜОпФҪОИ¶ЁЈ¬ЧоёЯјЫСх»ҜОпөДЛ®»ҜОпөДЛбРФФҪЗҝЈ¬ТФҙЛҪвҙрёГМвЎЈ
ЈЁ1Ј©Ч°ЦГAЦРКў·ЕөДКФјБКЗNa2SИЬТәЈ¬·ўЙъ Cl2+Na2S=2NaCl+SЎэЈ¬ҝЙЦӨГчClөД·ЗҪрКфРФЗҝЈ¬№Кҙр°ёОӘЈәbЈ»Cl2+Na2S=2NaCl+SЎэЈ»
ЈЁ2Ј©
aЈ®HClұИH2SОИ¶ЁЈ¬ҝЙЛөГчClөД·ЗҪрКфРФЗҝЈ¬№КaХэИ·Ј»
bЈ®ұИҪП·ЗҪрКфРФЈ¬УҰёщҫЭЧоёЯјЫСх»ҜОп¶ФУҰЛ®»ҜОпөДЛбРФЗҝИхЈ¬І»ДЬёщҫЭЖдСх»ҜРФЗҝИхұИҪПЈ¬№КbҙнОуЈ»
cЈ®HClO4әНH2SO4ҫщОӘClәНSөДЧоёЯјЫСх»ҜОп¶ФУҰЛ®»ҜОпЈ¬№КHClO4ЛбРФұИH2SO4ЗҝЈ¬ҝЙЛөГчClөД·ЗҪрКфРФЗҝЈ¬№КcХэИ·Ј»
dЈ®МъУлCl2·ҙУҰЙъіЙFeCl3Ј¬¶шБтУлМъ·ҙУҰЙъіЙFeSЈ¬ЛөГчВИЖшөДСх»ҜРФҪПЗҝЈ¬ФтClФӘЛШөД·ЗҪрКфРФҪПЗҝЈ¬№КdХэИ·ЎЈ
№Кҙр°ёОӘЈәbЈ»
ЈЁ3Ј©ИфТӘСйЦӨ·ЗҪрКфРФЈәClЈҫIЈ¬Ч°ЦГAЦРјУИлөн·Ыөв»ҜјШ»мәПИЬТәЈ¬№ЫІмөҪЧ°ЦГAЦРИЬТәұдА¶өДПЦПуЈ¬јҙҝЙЦӨГчЈ¬ЛөГч·ўЙъ·ҙУҰCl2+2I-=I2+2Cl-Ј¬ВИЖшөДСх»ҜРФұИөвЗҝЈ¬УГФӯЧУҪб№№АнВЫҪвКН·ЗҪрКфРФClЈҫIөДФӯТтЈәН¬ЦчЧеФӘЛШҙУЙПөҪПВЈ¬ФӯЧУ°лҫ¶өЭФцЈ¬өГөзЧУДЬБҰөЭјхЈ¬
№Кҙр°ёОӘЈәұдА¶Ј»ФӯЧУ°лҫ¶өЭФцЈ¬өГөзЧУДЬБҰөЭјхЎЈ


 ГҝИХ10·ЦЦУҝЪЛгРДЛгЛЩЛгМмМмБ·ПөБРҙр°ё
ГҝИХ10·ЦЦУҝЪЛгРДЛгЛЩЛгМмМмБ·ПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝНӯ°еЙПМъГӯ¶ӨіӨЖЪұ©В¶ФЪіұКӘөДҝХЖшЦРЈ¬РОіЙТ»ІгЛбРФЛ®ДӨәуМъГӯ¶Ө»бұ»ёҜКҙЈ¬КҫТвНјИзПВЎЈПВБРЛө·ЁІ»ХэИ·өДКЗ
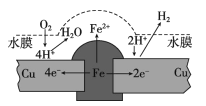
A. ёҜКҙ№эіМЦРНӯј«ЙПКјЦХЦ»·ўЙъЈә 2H++2e-= H2Ўь
B. ИфЛ®ДӨЦРИЬУРКіСОҪ«јУҝмМъГӯ¶ӨөДёҜКҙ
C. ИфФЪҪрКфұнГжНҝТ»ІгУНЦ¬ДЬ·АЦ№МъГӯ¶Өұ»ёҜКҙ
D. ИфҪ«ёГНӯ°еУлЦұБчёәј«ПаБ¬Ј¬ФтМъНӯҫщДСұ»ёҜКҙ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘПВБРИИ»ҜС§·ҪіМКҪЈәZn(s) +![]() O2(g) ЈҪZnO(s) ҰӨH1ЈҪЈӯ351.1kJ/mol
O2(g) ЈҪZnO(s) ҰӨH1ЈҪЈӯ351.1kJ/mol
Hg(l) +![]() O2(g) ЈҪ HgO(s) ҰӨH2ЈҪЈӯ90.7kJ/mol
O2(g) ЈҪ HgO(s) ҰӨH2ЈҪЈӯ90.7kJ/mol
УЙҙЛҝЙЦӘZn(s) + HgO(s) ЈҪ ZnO(s) + Hg(l)өДҰӨH3Ј¬ЖдЦРҰӨH3өДЦөКЗ
A.Јӯ260.4 kJ/molB.Јӯ254.6 kJ/molC.Јӯ438.9 kJ/molD.Јӯ441.8 kJ/mol
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЗҰРоөзіШКЗіЈУГөД»ҜС§өзФҙЈ¬Ждөзј«ІДБП·ЦұрКЗPbәНPbO2Ј¬өзҪвТәОӘПЎБтЛбЎЈ·ЕөзКұЈ¬ёГөзіШЧЬ·ҙУҰКҪОӘЈәPb+PbO2+2H2SO4![]() 2PbSO4+2H2OЎЈЗлёщҫЭЙПКцЗйҝцЕР¶ПЈә
2PbSO4+2H2OЎЈЗлёщҫЭЙПКцЗйҝцЕР¶ПЈә
(1)ёГРоөзіШөДёәј«ІДБПКЗ_________Ј¬·ЕөзКұ·ўЙъ_________ЈЁМоЎ°Сх»ҜЎұ»тЎ°»№ФӯЎұЈ©·ҙУҰЎЈ
(2)ёГРоөзіШ·ЕөзКұЈ¬өзҪвЦКИЬТәөДЛбРФ_________ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұЈ©ЎЈ
(3)ТСЦӘБтЛбЗҰОӘІ»ИЬУЪЛ®өД°ЧЙ«№ММеЈ¬ЙъіЙКұёҪЧЕФЪөзј«ЙПЎЈКФРҙіцёГөзіШ·ЕөзКұЈ¬Хэј«өДөзј«·ҙУҰ_______ЈЁУГАлЧУ·ҪіМКҪұнКҫЈ©ЎЈ
(4)ЗвСхИјБПөзіШҫЯУРЖф¶ҜҝмЎўР§ВКёЯөИУЕөгЈ¬ЖдДЬБҝГЬ¶ИёЯУЪЗҰРоөзіШЎЈИфөзҪвЦКОӘH2SO4ИЬТәЈ¬ФтЗвСхИјБПөзіШөДХэј«·ҙУҰКҪОӘ______________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗЈЁЎЎЎЎЈ©
A.ҝЙНЁ№эјУіЙ·ҙУҰКөПЦ![]() өДЧӘ»Ҝ
өДЧӘ»Ҝ
B.ЧйіЙФӘЛШөДЦКБҝ·ЦКэПаН¬Ј¬Па¶Ф·ЦЧУЦКБҝТІПаН¬өДІ»Н¬»ҜәПОпЈ¬Т»¶Ё»ҘОӘН¬·ЦТм№№Ме
C.әЛҙЕ№ІХсЗвЖЧЎўәмНв№вЖЧ¶јДЬ№»ҝмЛЩҫ«И·өШІв¶ЁУР»ъОпөДПа¶Ф·ЦЧУЦКБҝ
D.П©МюЦ»ДЬ·ўЙъјУіЙ·ҙУҰЈ¬І»ДЬ·ўЙъИЎҙъ·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёщҫЭПВБРКөСйПЦПуЈ¬ЛщөГҪбВЫХэИ·өДКЗ![]()
КөСй | КөСйПЦПу | ҪбВЫ |
A |
ЧуЙХұӯЦРМъұнГжУРЖшЕЭЈ¬УТұЯЙХұӯЦРНӯұнГжУРЖшЕЭ | »о¶ҜРФЈә |
B |
ЧуұЯГЮ»ЁұдОӘіИЙ«Ј¬УТұЯГЮ»ЁұдОӘА¶Й« | Сх»ҜРФЈә |
C |
°ЧЙ«№ММеПИұдОӘөӯ»ЖЙ«Ј¬әуұдОӘәЪЙ« | ИЬҪвРФЈә |
D |
Ч¶РОЖҝЦРУРЖшМеІъЙъЈ¬ЙХұӯЦРТәМеұд»лЧЗ | ·ЗҪрКфРФЈә |
A.AB.BC.CD.D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝКТОВПВЈ¬ПВБРИЬТәЦРОўБЈЕЁ¶И№ШПөТ»¶ЁХэИ·өДКЗЈЁ Ј©
A.0.1molЎӨLЈӯ1Na2CO3ИЬТәЦРЈ¬јУЛ®ПЎКНЈ¬![]() өДЦөјхРЎ
өДЦөјхРЎ
B.0.1molЎӨLЈӯ1өДБтЛбВБИЬТәЦРЈәc(SO42-)>c(Al3Ј«)>c(HЈ«)>c(OHЈӯ)
C.pHЈҪ7өД°ұЛ®УлВИ»Ҝп§өД»мәПИЬТәЦРЈәc(ClЈӯ)>c(NH4+)
D.pHЈҪ2өДҙЧЛбИЬТәәНpHЈҪ12өДNaOHИЬТәөИМе»э»мәПЈәc(NaЈ«)ЈҪc(CH3COOЈӯ)Ј«c(CH3COOH)
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРРрКцХэИ·өДКЗЈЁ Ј©
A. Ҫ«ПЎ°ұЛ®ЦрөОјУИлПЎБтЛбЦРЈ¬өұИЬТәpH=7КұЈ¬c(SO42-)Јҫc(NH4+)
B. БҪЦЦҙЧЛбИЬТәөДОпЦКөДБҝЕЁ¶И·ЦұрОӘc1әНc2Ј¬pH·ЦұрОӘaәНa+1Ј¬Фтc1=10c2
C. pH=11өДNaOHИЬТәУлpH=3өДҙЧЛбИЬТәөИМе»э»мәПЈ¬өОИлКҜИпИЬТәіКәмЙ«
D. Пт0.1 mol/LөД°ұЛ®ЦРјУИлЙЩБҝБтЛб粒ММеЈ¬ФтИЬТәЦР Фцҙу
Фцҙу
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶ҫЦШКҜөДЦчТӘіЙ·ЦОӘBaCO3(ә¬Ca2Ј«ЎўMg2Ј«ЎўFe3Ј«өИФУЦК),КөСйКТАыУГ¶ҫЦШКҜЦЖұёBaCl2ЎӨ2H2OөДБчіМИзПВ:
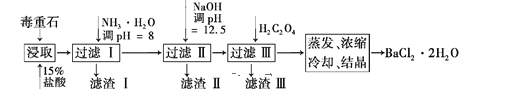
(1)¶ҫЦШКҜУГСОЛбҪюИЎЗ°Риід·ЦСРДҘ,ДҝөДКЗФцҙуҪУҙҘГж»эҙУ¶ш_____________ЎЈ
(2) јУИлNH3ЎӨH2OөчҪЪpH=8ҝЙіэИҘ____(МоАлЧУ·ыәЕ)Ј¬ҙЛКұЈ¬ИЬТәЦРёГАлЧУөДЕЁ¶ИОӘ______molЎӨLЈӯ1ЎЈФЩјУИлNaOHөчpH=12.5,ИЬТәДЪКЈУаөДСфАлЧУЦР______НкИ«іБөн,____Іҝ·ЦіБөн (МоАлЧУ·ыәЕ)ЎЈјУИлH2C2O4КұУҰұЬГв№эБҝ,ФӯТтКЗ____ЎЈТСЦӘ:Ksp(BaC2O4)=1.6ЎБ10Јӯ7,Ksp(CaC2O4)=2.3ЎБ10Јӯ9, KspЈЫFe(OH)3ЈЭ =2.6ЎБ10Јӯ39ЎЈ

(3УЙУЪNa2S2O5ҫЯУР¶ҫРФЈ¬ТтҙЛ№ъјТ¶ФЖдФЪКіЖ·ЦРөДУГБҝУРСПёсөД№ж¶ЁЎЈДі»ҜС§РЛИӨРЎЧйФЪІв¶ЁДі°ЧЖПМСҫЖЦРNa2S2O5өДІРБфБҝКұЈ¬ИЎ40mLЖПМСҫЖСщЖ·УЪЧ¶РОЖҝЦРЈ¬өОИлјёөОөн·ЫИЬТәЈ¬УГ0.02 molЎӨLЈӯ1өвөДұкЧјИЬТәөО¶ЁЦБЦХөгЈ¬ПыәДөвұкЧјИЬТә5mLЈ¬ФтөО¶ЁЦХөгөДПЦПуОӘ__________Ј¬Na2S2O5өДә¬БҝКЗТФSO2АҙјЖЛгөДЈ¬ФтёГСщЖ·ЦРNa2S2O5өДІРБфБҝТФ![]() јЖОӘ______
јЖОӘ______![]() ЎЈ
ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com