
����Ŀ��ijͬѧ�������������طֽ���O2�ⶨ��״��������Ħ�������̽��ʵ�顣
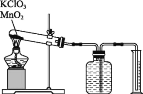
ʵ�鲽������:�����Ӻ�ʵ��װ��,���װ�õ������ԡ���������������ط�ĩ�������������̷�ĩ��Ͼ���,���������Թ���,ȷ�����Թܺ�ҩƷ��������Ϊ15.95g��������,��ʼ��Ӧ,ֱ���������������Ϊֹ��������������Ͳ��ˮ�����Ϊ285.0mL,����ɱ�״�������������Ϊ279.7mL����ȷ�����ԹܺͲ����������Ϊ15.55g����������ʵ�����,�ش��������⡣
��1����μ��װ�õ�������?________��
��2�������Dz����ռ��������������������ļ�������:��ʹ�Թܺ��ƿ�����嶼��ȴ������;��_____;����ȡ��Ͳ��Һ����������������ʵ�����ʱ,�����Ӷ���,���ȡ���������__ (����ƫ������ƫС��������Ӱ����)��
��3��ʵ������в������������ʵ�����______mol��ʵ���ñ�״����������Ħ�������__ (����С�������λ)��
���𰸡������ƿ��ע��ˮ,��������,��װ��ͼ���Ӻ�װ��,���ֽ��Թܵײ�����,���۲쵽���ƿ�г���������Һ������,�ɿ��ֺ�,��һ������������ڵ�Һ���½�,��֤����װ�ò�©�� ������Ͳ�ĸ߶�ʹ���ƿ����Ͳ�ڵ�Һ��߶���ͬ ƫС 0.0125 22.38 L��mol-1
��������
(1)װ�������Լ����ԭ����:ͨ�����巢�����븽���Һ�幹�ɷ����ϵ�����ݸı���ϵ��ѹǿʱ����������(�����ݵ����ɡ�ˮ�����γɡ�Һ���������)���ж�װ�������ԣ�
(2)Ҫȷ��������������뱣����Ͳ����������¶Ⱥ�ѹǿ��ȣ�����ڶ�ȡ��Ͳ����������֮ǰ��Ӧʹ�Թܺ���Ͳ�ڵ����嶼��ȴ�����£��ٵ�����Ͳ����Һ��߶�ʹ֮��ͬ�����Ӷ���ƫС��
(3)�Թܺ�ҩƷ��ʵ��ǰ��������Ϊ���ɵ���������������������Ħ����n=V/Vm���㡣
(1)װ�������Լ����ԭ����:ͨ�����巢�����븽���Һ�幹�ɷ����ϵ�����ݸı���ϵ��ѹǿʱ����������(�����ݵ����ɡ�ˮ�����γɡ�Һ���������)���ж�װ�������ԣ����ȸ��������ȡ����ʱ�ļ���װ�������Եķ���Ϊ�������ƿ��ע��ˮ��������Ƥ������װ��ͼ���Ӻ�װ�ã����ֽ��Թܵײ����ȣ����۲쵽���ƿ�г���������Һ���������ɿ��ֺ�,��һ�᳤�������ڵ�Һ���½�����֤����װ�ò�©����
�ʴ��ǣ������ƿ��ע��ˮ��������������װ��ͼ���Ӻ�װ�ã����ֽ��Թܵײ����ȣ����۲쵽���ƿ�г���������Һ���������ɿ��ֺ�,��һ������������ڵ�Һ���½�����֤����װ�ò�©����
(2)��Ϊ�ų�����������Ҫ���ų���ˮ����������ģ�����Ӧǰ�����Ͳ�¶��Dz�ͬ�ģ���˷�Ӧ��ֹӦ����ֹͣ���ȣ�����ϵ�ָ�������ʱ����ȡ�����ܣ���һ��������ͨ����ʵ�鲻ͬ������ֹͣ����ʱ���ܵij���Ҫ������Ͳ�ڵ�Һ�棬��ʱ��ʹ��ȡ�����ܶ�ֹͣ���ȣ�Ҳ�������ˮ�ĵ�����ֹͣ���ȡ��ص����º���Ͳ�����Ե�����Ͳ�ڵ�Һ����ˮ��һ�£���ʱ��Ͳ������ѹǿҲΪ����ѹ������������ȷ�ģ����Բ���˳��Ϊ:��ʹ���嶼��ȴ�����£��ڵ�����Ͳ����Һ��߶�ʹ֮��ͬ���۶�ȡ��Ͳ������������������Ͳ�Ľṹ��֪�����Ӷ���ʹ�ö���ƫС��
�ʴ���: ������Ͳ�ĸ߶�ʹ���ƿ����Ͳ�ڵ�Һ��߶���ͬ��ƫС��
(3)���ɵ�����������m=15.95-15.55=0.4g���������ʵ���n=m/M=0.4/32=0.0125mol�����������V=279.7mL=0.2797L��������Ħ�����Vm=V/n=0.2797L/0.0125mol=22.38 L��mol-1��
�ʴ���: 0.0125�� 22.38L��mol-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڼ��������˵���У�����ȷ����
A.������������
B.��CH3CH2CH3��Ϊͬϵ��
C.��������ˮ������
D.�ڿ����е�ȼ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ư���ڹ�ҵ��������Ҫ��Ӧ�ã�ijͬѧ��������������ʵ���ҽ����Ʊ�Ư�۵�ʵ�顣��ش��������⣺
I.�������Ʊ�
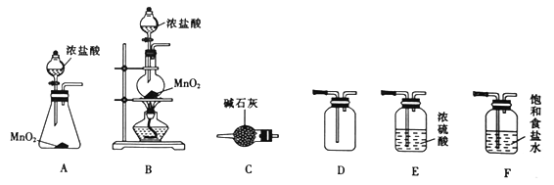
��1��װ��C������Ϊ_______________��
��2��ʵ����ѡ����ͼ�е�װ���Ʊ����ռ�����������������˳��Ϊ_______________������ĸ����
��3��װ��F������Ϊ___________________________��
��.Ư�۵��Ʊ�
��4����֪��������ʯ�����ڷ�Ӧ�Ĺ����л���ȣ����¶Ƚϸ�ʱ������Ca(ClO3)2��Ϊ���Ƶô��Ƚϸߵ�Ư�۲���߲��ʣ�ʵ���пɲ�ȡ�Ĵ�ʩ��__________________��____________________�����ı�ʯ�����Ũ�Ⱥ��������
��5������100 mL 12.0 molL-1������3.48 g MnO2��Ӧ�Ƶõ�����ȫ��ͨ��������ʯ�����У������������Ƶ�Ca(ClO)2_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨʵ���ҳ��ڴ�ŵ�Na2SO3����Ĵ��ȣ�ȷ��ȡw g������Ʒ�����250 mL��Һ���������������ʵ�鷽����
����I��ȡ25.00 mL������Һ�����������������ữ��BaCl2��Һ������I��ϴ������������������õ�����������Ϊm1 g
��������ȡ25.00 mL������Һ����a mol/L ������KMnO4��Һ���еζ���(5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O)
�ζ�����ʵ������ | 1 | 2 | 3 | 4 |
������Һ���/mL | 25.00 | 25.00 | 25.00 | 25.00 |
�ζ��ܳ�����/mL | 0.00 | 0.20 | 0.10 | 0.15 |
�ζ���ĩ����/mL | 19.95 | 20.20 | 19.15 | 20.20 |
ʵ��������¼���������±���
��1������250 mL Na2SO3��Һʱ�������õ���ʵ�������У��ձ�������������ͷ�ιܡ���Ͳ��ҩ��_________��____________��
��2������IΪ________������Ϊ____________
��3������I������жϼ�����Ȼ����Ѿ�����_____________���ڷ������еζ��յ���жϷ�����________________��
��4�����ݷ��������ṩ�����ݣ�����Na2SO3�Ĵ���Ϊ_________��
��5������ʵ���У����ڲ����������������������ȷ����_________
A.����I����û��ϴ�Ӳ�����ʵ������ƫС
B.����I����û�в�������ʵ������ƫ��
C.�������У��ζ����ڵζ�ǰ�����ݣ��ζ���������ݣ�ʵ����ƫС
D.�������У��ζ��յ�ʱ���Ӷ�����ʵ����ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����200mLMgCl2��AlCl3�Ļ����Һ������c(Mg2+)Ϊ0.2moI��L-1��c(Cl-)Ϊ1.3mol��L-1��ҪʹMg2+��ȫת��Ϊ�������������������Ҫ��4mol��L-1 NaOH��Һ�����Ϊ___mL��
��2��ij��Һ��ֻ����Na+��Al3+��Cl����SO42���������ӣ���֪ǰ�������ӵĸ�����Ϊ3��2��1������Һ��Al3���� SO42�������Ӹ�����Ϊ___��
��3��5.85gNaCl��xgMgCl2һ������ˮ���1L��Һ�����Cl�����ʵ���Ũ��Ϊ0.3mol��L��1����x��ֵΪ___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ6NO2��8NH3===7N2��12H2O���ɵ�ص�װ����ͼ��ʾ���˷�������ʵ����Ч�������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܡ�����˵����ȷ���ǣ���

A. ���������缫�������غ������Ҳ�缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ2NH3��6e��===N2��6H��
D. ����4.48 L NO2������ʱ��ת�Ƶ�����Ϊ0.8NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Zn��H2SO4��ZnSO4��H2����Q�Ļ�ѧ��Ӧ��������������ȷ����
A.��Ӧ������������ϵ��ͼ��ʾ
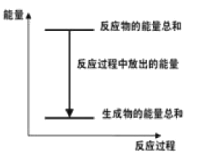
B.Q��ֵ�뷴Ӧ�ļ���ϵ���й�
C.������Ӧ��Ƴ�ԭ���пΪ����
D.���������Ϊԭ��أ�����32.5gп�ܽ⣬�����ų�������һ��Ϊ11.2L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(C6 H 5COOH)��һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ������ҩ�ͻ�����ҵ��ij��ѧС���üױ�����Ҫԭ���Ʊ�������IJ������£�
����һ������ͼ����ʾװ�õ�����ƿ�м���2.7mL�ױ�(2.3g)��100mLˮ��2��3Ƭ���Ƭ�������綯��������a��ͨ��������ˮ����ʯ�����ϼ��������ڣ�Ȼ���������8.5g������أ���100��ʱ����������Լ4~5h����ֹͣ��Ӧ��

�����������Ӧ��Ļ��Һ���ˣ���Һ��Ũ�����ữ����ͼ����ʾ��װ�ó��˵ôֲ�Ʒ��
�����������ֲ�Ʒ�����ؽᾧ���ô�Ʒ�����ᡣ
�ױ���������ء�������IJ����������ʼ��±���

��1������A������Ϊ___________�����ˮ����___________(����a������b��)��
��2������һ�У�Ӧ������ƿ�й۲쵽_________________________________������ʱ��ͣ����Ӧ��
��3����Ӧ����ʱ���������ƿ�л��ҺΪ���ԣ�������ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽΪ_________________________________(�ڱ�ʵ�������£�������صĻ�ԭ������MnO2)
��4��������г��˵��ŵ���____________________________________________��
��5����ͼ����ʾ�������ʱ��Ӧ�ȶϿ�______________________֮�����Ƥ�ܡ�
��6��������У������Һ����ɫ��Ҫ�ȼ�KHSO3��ԭ����______________________��
��7�����ᴿ�õ�2.9g�����ᣬ�����IJ�����___________%��(������С�����һλ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��CH3COOH�ĵ���ƽ�ⳣ��ΪK����20mL 0.1mol/L CH3COOH��Һ����μ���0.1mol/L NaOH��Һ����pH�仯������ͼ��ʾ�������¶ȱ仯��������˵������ȷ���ǣ� ��

A. b���ʾ����Һ��c(Na+)��c(CH3COO��)
B. c���ʾCH3COOH��NaOHǡ�÷�Ӧ��ȫ
C. d���ʾ����Һ��c(CH3COO��) c(H+)/c(CH3COOH)����K
D. b��c��d�����ʾ����Һ��һ�������ڣ�c(Na+)+c(H+)�Tc(CH3COO��)+c(OH��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com