
【题目】下列说法正确的是
A.可用澄清石灰水鉴别二氧化硫和二氧化碳
B.将二氧化硫通入氯化钡溶液中无明显现象,不断振荡,溶液变浑浊
C.工业上或实验室用亚硫酸钠固体与稀硫酸反应制备二氧化硫
D.二氧化硫能使含酚酞的氢氧化钠溶液褪色,体现了其漂白性
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】胡椒酚是一种挥发油,可从植物果实中提取,具有抗菌、解痉、镇静的作用,其结构简式为CH2=CH-CH2![]() OH。
OH。
(1)胡椒酚的分子式是_______。
(2)胡椒酚所含官能团的名称是_______、_______。
(3)胡椒酚与NaOH溶液反应的化学方程式是_______。
(4)1 mol胡椒酚与H2发生加成反应,理论上最多消耗_______ mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质间的转化关系如下图所示(部分产物已略去)

(1)若A是地売中含量最多的金属元素,将A的氯化物溶液和氢氧化钠溶液等体积混合,得到的沉淀物中A元素与溶液中A元素的质量相等,则A的该氯化物溶液和氢氧化钠溶液的物质的量浓度之比可能为____________。
(2)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如图所示:则A与B溶液反应后溶液中的溶质为___________(填化学式),物质的量之比为_______。

(3)若A是一种正盐,A能分别与B、F溶液反应生成无色且具有刺激性气味的气体,则A的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关单质用途的说法不正确的是
A.充有钠蒸气的高压钠灯常用于道路和广场的照明
B.还原铁粉可用作食品袋内的抗氧化剂
C.镁是一种重要的金属材料,是优质的耐高温材料
D.氯气可用于自来水的消毒、药物的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2+3H2 ![]() 2NH3,下列说法处于化学平衡状态的是( )
2NH3,下列说法处于化学平衡状态的是( )
①υ(N2)正=υ(N2)逆,
②N2、H2、NH3的分子数之比为1∶3∶2,
③单位时间内生成2molNH3,同时消耗1molN2,
④N2、H2、NH3的物质的量不再发生变化。
A. ①④B. ②③C. ②③④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氢化物种类繁多,其中联氨(又称肼,N2H4,无色油状液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__________________,其中氮的化合价为 _________。
(2) ①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=____________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________。
(3)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并且有气泡产生,写出该反应的化学方程式__________________。
(4)联氨还可以用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2_____kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃 的说法正确的是
的说法正确的是
A. 共面的C原子最多为14个
B. 共直线的C原子只有为4个
C. 1mol该烃最多可以和6molH2发生加成反应
D. 1mol该烃最多可以消耗6molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________。
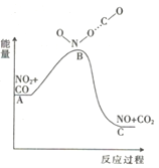
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
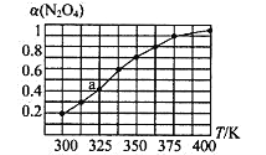
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
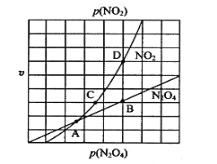
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。
(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
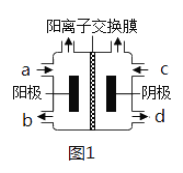
①收集到(CH3)4NOH的区域是______(填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com