
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________。
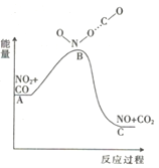
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
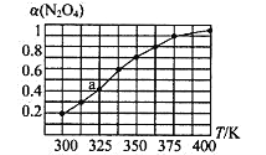
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
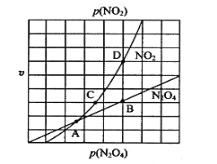
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。
(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
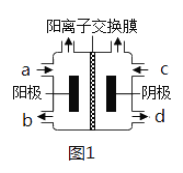
①收集到(CH3)4NOH的区域是______(填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________。
【答案】C > 温度升高,α(N2O4)增加,说明平衡右移。该反应为吸热反应,△H>0 115.2 k2×Kp/2 B点D点 d 2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑
2(CH3)4NOH+H2↑+Cl2↑
【解析】
(1)A、A→B能量升高,属于吸热过程,故A错误;
B、反应物的能量高于生成物的能量,此反应为放热反应,则1molNO2和1molCO的键能总和小于1molNO和1molCO2的键能总和,故B错误;
C、反应中C和N的化合价发生变化,则反应属于氧化还原反应,故C正确;
D、根据图像,反应物总能量高于生成物总能量,则1molNO2和1molCO的总能量高于1molNO和1molCO2的总能量,故D错误;
(2)①随着温度的升高,N2O4转化率增大,升高温度平衡向正反应方向进行,根据勒夏特列原理,正反应方向为吸热反应,即△H>0;
②令起始时N2O4物质的量为1mol,N2O4(g)![]() 2NO2(g)
2NO2(g)
起始: 1 0
变化: 0.4 0.8
平衡: 0.6 0.8 其他条件相同,压强之比等于物质的量之比,达到平衡时的压强为108×1.4/1kPa=151.2kPa,NO2的物质的量分数为0.8/(0.6+0.8)=4/7,N2O4的物质的量分数为3/7,根据平衡常数的定义,Kp= =115.2kPa;
=115.2kPa;
③化学平衡常数Kp=[p(NO2)]2/p(N2O4),利用速率之比等于化学计量数之比, v(N2O4)/v(NO2)=1/2,将公式代入,得出![]() =1/2,得出k1=k2×Kp/2;满足平衡条件,v(NO2)=2v(N2O4),即为平衡点,BD点的压强之比等于其反应速率之比的1:2,所以BD点为平衡点;
=1/2,得出k1=k2×Kp/2;满足平衡条件,v(NO2)=2v(N2O4),即为平衡点,BD点的压强之比等于其反应速率之比的1:2,所以BD点为平衡点;
(4)①以石墨为电极电解四甲基氯化铵制备四甲基氢氧化铵,需要OH-的参加,电解过程中阴极得到电子生成H2,得到OH-,收集到四甲基氢氧化铵的区域是阴极区,即d口;
②根据电解原理,电解过程中生成物为四甲基氢氧化铵、H2和Cl2,电解反应的化学方程式为2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑。
2(CH3)4NOH+H2↑+Cl2↑。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.可用澄清石灰水鉴别二氧化硫和二氧化碳
B.将二氧化硫通入氯化钡溶液中无明显现象,不断振荡,溶液变浑浊
C.工业上或实验室用亚硫酸钠固体与稀硫酸反应制备二氧化硫
D.二氧化硫能使含酚酞的氢氧化钠溶液褪色,体现了其漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠能与二氧化碳反应,在“神七”的航天舱中、在宇航员太空漫步时穿的航天服中、在潜艇中均使用过氧化钠作制氧剂,供人呼吸之用。某学生选用大理石、盐酸和一定量过氧化钠药品设计实验,验证这一事实。
请根据所给装置回答下列问题:

(1)A是制取CO2的装置,最好选用下列装置中的______________ (填序号)。

(2)B装置中发生的离子方程式是_______________________。C装置的作用是_______________________。
(3)D装置中发生反应的化学方程式是_________________。
(4)要想得到较纯净的氧气,可在装置D和E之间增加一盛有________(填写试剂名称)的________(填写装置名称)。
(5)如何检验集气瓶中收集到的气体______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图。回答下列问题:

(1)该反应的化学方程式为 。
(2)0~t1 s内A气体的反应速率为 。
(3)反应后与反应前的压强之比为 。
(4)(t1+10)s时,A气体的体积分数为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(5)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有关信息完成下列各题:
(1)有机物A是有机物B(![]() )的同分异构体,核磁共振氢谱测得其分子中只有两种不同化学环境的氢,且数目比为1:3,写出其中三种的结构简式:____、____、____。
)的同分异构体,核磁共振氢谱测得其分子中只有两种不同化学环境的氢,且数目比为1:3,写出其中三种的结构简式:____、____、____。
(2)有机物B在一定条件下反应生成有机物C,1mol有机物C最多可以和2molBr2发生加成反应,写出有机物B在一定条件下反应生成有机物C的化学方程式:____。
(3)已知:![]() 。
。
写出用![]() 为原料(其他无机试剂任选)制备高分子
为原料(其他无机试剂任选)制备高分子 的合成路线____。合成反应流程图表示方法例如:
的合成路线____。合成反应流程图表示方法例如:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)画出磷原子的原子结构示意图:______。
(2)写出H2S分子的电子式:________。
(3)写出表示含有8个质子,10个中子的原子的化学符号:______。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a=____。
(5)用电子式表示氯化镁的形成过程:____。
(6)写出Na2O2中所含化学键的类型______。
(7)拆开1mol H—H键,1mol N—H键, 1mol![]() 键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
(8)利用下列反应:Fe+Cu2+=Fe2++Cu 制一个化学电池,写出电极反应式:负极:___;正极__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是( )

A. 只有④ B. 只有③
C. ③和④均错误 D. 全部错误
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Cl、SO42、SO32、HCO3、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验,下列说法不正确的是

A. 气体A可能是CO2或SO2
B. 溶液X中一定存在SO42
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D. 向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________________________ 。
(2)表中能形成两性氢氧化物的元素是 ________ (/span>用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式 ________________________ 。
(3)④元素与⑦元素形成化合物的电子式 _____________________________ 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 ____(填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 ____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com