
【题目】环戊二烯容易发生聚合生成二聚体,该反应为:2![]()
![]()
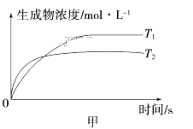
![]() ΔH<0。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是
ΔH<0。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是

A.T1<T2
B.a点的正反应速率大于b点的逆反应速率
C.达平衡后,T1温度下环戊二烯的浓度大于T2温度下环戊二烯的浓度
D.反应开始至b点时,双环戊二烯平均速率约为:0.45molL-1h-1
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】反应CO(g)+2H2(g)![]() 2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
组序号 | 1 | 2 | 3 | 4 | |
反应温度/℃ | 225 | 235 | 225 | 235 | |
反应前气体的物质的量/mol | CO2 | 0 | 0 | 0.2 | 0.2 |
CO | 3.0 | 3.0 | 2.8 | 2.8 | |
H2 | 7.0 | 7.0 | 7.0 | 7.0 | |
平衡时CH3OH的体积分数/% | 4.9 | 8.8 | 36.5 | 50.7 | |
A.该反应的△H>0
B.当容器中压强不变时,反应达到平衡
C.CH3OH含量增大的原因是CO2
D.少量CO2能提高平衡时CH3OH的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,此反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、K2SO4、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,其所具有的性质是__________。
①丁达尔效应 ②加入饱和(NH4)2SO4溶液产生聚沉 ③可通过半透膜
(2)请用上述物质填空,并配平化学方程式:____C+____+____H2SO4→____K2SO4+________+____Cr2(SO4)3+____H2O。
(3)H2SO4在上述反应中表现出来的性质是________(填选项编号)。
A.氧化性 B.氧化性和酸性
C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A蒸汽的密度是相同状况下氢气密度的36倍,已知该烃中碳、氢元素的质量比为5:1,回答下列问题:
(1)该烃的相对分子质量为__________________。
(2)该烃的分子式为__________________。
(3)该烃有____________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g) ![]() cC(g)+dD(g) ΔH,同时符合下列两图中各曲线规律的是( )
cC(g)+dD(g) ΔH,同时符合下列两图中各曲线规律的是( )
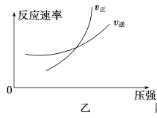
A.a+b>c+d T1>T2 ΔH>0
B.a+b>c+d T1<T2 ΔH<0
C.a+b<c+d T1>T2 ΔH>0
D.a+b<c+d T1<T2 ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将浓度为![]()
![]() HF溶液加水不断稀释过程中,
HF溶液加水不断稀释过程中,![]() 保持不变,电离度变大,溶液中所有离子的浓度均变小
保持不变,电离度变大,溶液中所有离子的浓度均变小
B.![]() 时,将
时,将![]() 的一元强酸溶液与
的一元强酸溶液与![]() 的一元碱溶液等体积混合后,所得溶液呈酸性或中性
的一元碱溶液等体积混合后,所得溶液呈酸性或中性
C.![]()
![]()
![]() 溶液与
溶液与![]()
![]()
![]() 溶液等体积混合所得溶液中:
溶液等体积混合所得溶液中:![]()
D.对于沉淀溶解平衡![]() ,已知平衡常数
,已知平衡常数![]() ,AgCl的平衡常数大于AgI,则含AgCl和AgI固体的悬浊液中存在:
,AgCl的平衡常数大于AgI,则含AgCl和AgI固体的悬浊液中存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:
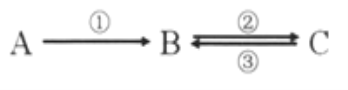
其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
(2)如何检验上述C溶液中的阳离子?______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是____________,属于置换反应____________,(填序号)写出反应①的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
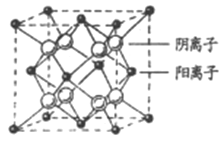
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(﹣lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(﹣lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A. 该反应的△H>0
B. A点对应状态的平衡常数K(A)=10﹣2.294
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的υ(正)< υ(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com