
(5分)请填出下列各混合物的分离方法
(1)食盐水与泥沙____________(2)海水晒盐__________(3)苯和水__________
(4)蒸馏水的制取____________(5)用CCl4将碘水中的碘提取出来__________
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
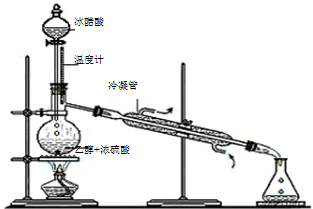 有机化学知识在生活中应用广泛.
有机化学知识在生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
(1)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com