
【题目】向下列溶液:①盐酸 ②氯酸钾 ③氯化钠 ④四氯化碳中分别加AgNO3溶液和稀HNO3,能生成白色沉淀的是
A. ①② B. ②③ C. ①③ D. ②④
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、科研密切相关,下列有关说法不正确的是( )
A.铝合金大量用于高铁建设
B.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
C.高纯硅可用于制作光感电池
D.氢氧化铝可用于中和过多胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中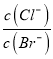 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是
A. 10g H2和10g O2
B. 5.6L N2(标准状况)和11g CO2
C. 18g H2O和0.5mol Br2
D. 224 mL H2(标准状况)和0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是 ( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A. ①和② B. ①和④ C. ③和④ D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载了草木灰的获取及使用的过程——“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”。下列有关该记载的说法中,不正确的是( )
A.“以灰淋汁”的操作是过滤B.“薪柴之灰”可与铵态氮肥混合施用
C.“取碱”得到的实际是一种盐溶液D.“浣衣”过程有化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁煅烧反应为2FeSO4(s)![]() SO2(g)+Fe2O3(s)+SO3(g),有关说法正确的是 ( )
SO2(g)+Fe2O3(s)+SO3(g),有关说法正确的是 ( )
A. 该反应中每生成1 mol Fe2O3转移电子数约为1×6.02×1023
B. SO2能使溴水褪色,说明SO2具有漂白性
C. 该反应中FeSO4既作氧化剂又作还原剂
D. 该反应生成的气体通入足量BaCl2溶液中,可得到BaSO3和BaSO4两种沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com