
【题目】设NA代表阿伏加德罗常数的数值。下列说法中正确的是( )
A.0.1 mol Cl2与足量NaOH溶液反应,转移电子数为0.2 NA
B.0.1 mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15 NA
C.常温常压下,100 mL 0.5 mol/L的乙二酸溶液中,总的离子数目大于0.15 NA
D.10 g D2O所含的中子数为4 NA
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。问:
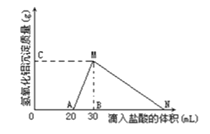
(1)此溶液中同时含有____________mol______离子;
(2)用离子方程式表示MN段发生的反应是________________________
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)________________
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为__________mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定下列各混合物中铝的质量分数,设计了如下实验方案:
①铜铝混合物![]() 充分反应测定生成气体的体积
充分反应测定生成气体的体积
②铜铝混合物![]() 充分反应测定剩余固体的质量
充分反应测定剩余固体的质量
③铜铝混合物![]() 充分反应测定所得固体的质量
充分反应测定所得固体的质量
④铁铝混合物![]() 充分反应测定生成气体的体积
充分反应测定生成气体的体积
以上方案可行的是( )
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aA(g) +bB(g)![]() cC(g)( △H <0)在等容条件下进行。改变其他反应条件,在I、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)( △H <0)在等容条件下进行。改变其他反应条件,在I、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a:b:c为 ;
(2)A的平均反应速率vI (A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(3)B的平衡转化率![]() I (B)、
I (B)、![]() Ⅱ(B)、
Ⅱ(B)、![]() Ⅲ (B)中最小的是 ,其值是 ;
Ⅲ (B)中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“ >、=、< ”)判断的理由是 ;
(6)达到第三阶段平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出 A、B、C)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中发生可逆反应C(s)+H2O(g) ![]() CO(g)+H2(g),一定能说明该反应己达到平衡状态的是( )
CO(g)+H2(g),一定能说明该反应己达到平衡状态的是( )
A.v逆(H2O)=v正(CO) B.容器中物质的总质量不发生变化
C.n(H2O):n(H2)=1:1 D.生成lmolCO的同时生成lmolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中应用广泛,下列物质性质与对应用途错误的是
A. 明矾易水解生成胶体,可用作净水剂 B. 晶体硅熔点高硬度大,可用作芯片
C. 氮气化学性质稳定,可用作粮食保护气 D. 溴化银见光易分解,可用作胶片感光剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在澄清透明溶液中,下列各组离子能大量共存的是
A. HCO3-、ClO-、Na+、H+ B. Cl-、NH4+、NO3-、H+
C. K+、Cu2+、Cl-、SO42- D. OH-、Mg2+、Na+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知4NH3+5O2![]() 4NO+6H2O(g),若化学反应速率分别是用v(NH3)、v(O2)、v(NO)、v(H2O)(单位mol/(L·min))表示,则正确的关系是()
4NO+6H2O(g),若化学反应速率分别是用v(NH3)、v(O2)、v(NO)、v(H2O)(单位mol/(L·min))表示,则正确的关系是()
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com