
����Ŀ����ӦaA(g) +bB(g)![]() cC(g)( ��H <0)�ڵ��������½��С��ı�������Ӧ��������I������������ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��
cC(g)( ��H <0)�ڵ��������½��С��ı�������Ӧ��������I������������ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ��

�ش�����:
(1)��Ӧ�Ļ�ѧ����ʽ�У�a:b:cΪ ��
(2)A��ƽ����Ӧ����vI (A)��v��(A)��v��(A)�Ӵ�С���д���Ϊ ��
(3)B��ƽ��ת����![]() I (B)��
I (B)��![]() ��(B)��
��(B)��![]() �� (B)����С���� ����ֵ�� ��
�� (B)����С���� ����ֵ�� ��
(4)�ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ����� ����ȡ�Ĵ�ʩ�� ��
��5���Ƚϵ����η�Ӧ�¶�(T2)�͵����η�Ӧ�¶ȣ�T3)�ĸߵ�:T2 T3(���� >��=��< ��)�жϵ������� ��
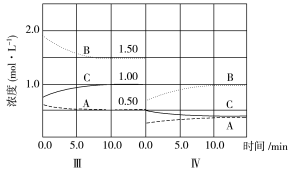
��6���ﵽ������ƽ����������������һ�����ٶ�10 min��ﵽ�µ�ƽ�⣬������ͼ�������߱�ʾ��IV����ϵ�и����ʵ�Ũ����ʱ��仯�����ƣ������ϱ����� A��B��C)��

���𰸡�(1)1��3��2��(2)v��(A)��v��(A)��v��(A)��(3)����(B)��0.19(19%)��
(4)������Ӧ�������ӷ�Ӧ��ϵ���Ƴ�����C��
(5)�����˷�ӦΪ���ȷ�Ӧ�������¶���ƽ��������Ӧ�����ƶ�
(6)
(ע��ֻҪ�����ܱ�ʾ��ƽ�����淴Ӧ�����ƶ���������Ũ�ȵ���Ա仯��������)��
��������
�����������1�����ݻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���Ϊͬһ�����ⶨ��������ʵ���Ũ�ȱ仯���ڻ�ѧ������֮�ȣ�a��b��c=(2��1)��(6��3)��2=1��3��2����2�����ŷ�Ӧ�Ľ��У�A��Ũ�Ȳ��ϼ�С��Ũ�ȼ�С����Ӧ���ʼ�������v��(A)��v��(A)��v��(A)����3������ת���ʵĶ��壬��I(B)=(6��3)/6��100%��50%����II(B)=(3��1.86)/3��100%=38%����III(B)=(1.86��1.5)/1.86��100%=19.4%�������III(B)��С����4����II�ε�ͼ��C��0��ʼ��˲��AB��Ũ�Ȳ��䣬��˷�Ӧ������Ӧ������У��Ӳ������Ƴ�C����5������A��B�������٣�C�������ӣ����жϴ�ƽ��������Ӧ�����ƶ�����Ӧ�Ǹı�Ũ�ȣ���Ϊ�ݻ��������������˸ı�ѹǿҲ�����ܣ�ֻ���Ǹı��¶ȣ���˴˷�Ӧ�Ƿ��ȷ�Ӧ��������������ԭ����Ӧ�ǽ����¶ȣ���T2>T3��(6)�������һ����ѹǿ����һ����Ũ�ȱ�Ϊԭ����1/2����Сѹǿ��ƽ�����淴Ӧ�����ƶ�������ֵ����ʵ���Ũ�ȱ仯��֮�ȵ��ڻ�ѧ�������ȣ����ͼ���ǣ� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����ʵ������ȡCO2����Ĺ����У������õ���Ũ���ᣬ�����Ƶõ�CO2�����л���HCl���壬������������³�ȥHCl���岢̽��CO2��������ƣ�Na2O2����Ӧ��ʵ�顣
��ش��������⣺

��1��װ��A�������ǣ� ��
��2��Ϊȷ����Ӧ��װ��BӲ�ʲ������й���ijɷ֣�С��ͬѧȡ�����������Թ��У���������������ˮ�ܽ��γ���ҺM�������ݲ�������ù����в��� ����С��ͬѧ��������̽����
��������⡿��Ӧ��Ӳ�ʲ������й���ijɷ���ʲô��
���������롿����һ��Na2CO3 �������NaOH ��������Na2CO3��NaOH���������ۣ����һ����Ϊ������������������ǣ� ���û�ѧ��Ӧ����ʽ��ʾ����
��ʵ����֤��С��ͬѧȡ�����γɵ���ҺM���Թ��У������м�������� ��Һ����������ɫ���������ˣ�����Һ�еμӼ��η�̪��Һ����Һ��죬��֤��������������
��������˼��С������ͬѧ��Ϊ����������Һ�еμӵķ�̪��Һ��������ͭ��Һ��Ҳ�ܵó�ͬ���Ľ��ۣ�����Ϊ��ͬѧ�Ĺ۵� ��������ȷ���������������������ǣ� ���û�ѧ��Ӧ����ʽ��ʾ����
����չ���졿��ʢ���Ȼ�泥�NH4Cl��Ũ��Һ���Թ��У����������Ĺ������ƣ�Na2O2�����壬�����ݲ����������������ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧѡ��2 -��ѧ�뼼δ��
I.ij���̿������Ҫ�ɷ���MnCO3��MnO2��FeCO3��SiO2 ��A12O3�ȡ���֪FeCO3��MnCO3������ˮ��һ������������Ĥ��ⷨ���¼��������ڴ�̼���̿�����ȡ�����̣���Ҫ����ת����ϵ���£�
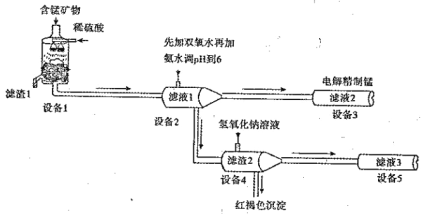
(1)�豸���з�Ӧ����Һ1����Ԫ��ֻ��Mn2+����ʽ���ڣ�������1��Ҳ��MnO2�� ����1����Ҫ�ɷ��� (�ѧʽ����
(2)�豸1�з���������ԭ��Ӧ�����ӷ���ʽ�� ��
(3)�豸2�м�����˫��ˮ�������� �����ʵ�鷽��������Һ2���Ƿ����Fe2+: ��
(4)�豸4�м����������������Һ�����������ܽ⣬�û�ѧƽ���ƶ�ԭ������ԭ�� ��
��5���豸3����������Ĥ����ȡ�����̵ĵ��װ����ͼ��

�����װ���м�ͷ��ʾ��Һ���������ƶ��ķ���;��A�缫��ֱ����Դ�� ����ʵ�������У�������ϡ����Ϊ���Һ�������ĵ缫��ӦʽΪ__ ___��
���ù���֮���Բ��������ӽ���Ĥ����Ϊ�˷�ֹMn2+ ������������������Ӧ����MnO2�����Դ�˷ѣ�д���ø���Ӧ�ĵ缫��Ӧʽ ��

II.��ͭ�����Ҫ�ɷ���Cu2S��FeS,��������Al2O3��SiO2���ʡ��ɱ�ͭ��ұ������ͭ����������:
��֪�����ӳ����ķ�Χ���±�
���� | Fe3+ | Fe2 + | Cu2+ |
��ʼ����pH | 1.9 | 7.0 | 6.7 |
������ȫpH | 3.4 | 9.0 | 10.0 |
��ش��������⣺
��1������ͭ������Ŀ������߽����ʣ�����һ����߽����ʵĴ�ʩ�� ��
��2����Һ1�ijɷ��� ����������ͨ��������CO2���������ij����� ����ʱ��Һ�е����ʽ���� ��
��3������1����H2O2��ϡH2SO4����Һ��������ֻ��SO42-��������������Cu2+ ��F3+����ù��̵����ӷ���ʽΪ: ��
��4)��Һ2���ڵ�pH��ΧΪ ��
��5���Ժ��ɫ��������ϴ�Ӳ����ﴦ�������Եõ�������Fe(OH)3���������Ʊ���ɫ����Fe2O3��������ɫ�����Ƿ�ϴ���ķ����� ��
(6)�ö��Ե缫����Һ3���е�⣬���CuSO4��Һ�Ļ�ѧ����ʽΪ�� ����������������״����44.8 L���������������������������֮��Ϊ1: 1ʱ����������ͭ������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ᷴӦ������������������Һ��Ӧ��������( )
A. AlCl3 B. NaAlO2 C. Al(OH)3 D. Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з������ʵķ����У�����ȷ����(����)
A. ���÷���ķ�����ʯ���з�������ͺ�ú��
B. ���÷�Һ�ķ�����ˮ�;ƾ�����
C. ���ýᾧ�ķ�����ȥ������л��е������Ȼ���
D. ���ù��˵ķ�����ȥˮ�е���ɳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ���������ֵ������˵������ȷ������ ��
A��0.1 mol Cl2������NaOH��Һ��Ӧ��ת�Ƶ�����Ϊ0.2 NA
B��0.1 mol�������ڹ����������ȼ�գ����ɵĻ���������������Ϊ0.15 NA
C�����³�ѹ�£�100 mL 0.5 mol/L���Ҷ�����Һ�У��ܵ�������Ŀ����0.15 NA
D��10 g D2O������������Ϊ4 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��ơ��Ȼ������Ȼ��������Ȼ������Ȼ�þ������Һ��ֻ��һ���Լ����ܼ������������Լ���
A��KSCN B��BaCl2 C��NaOH D��HCI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Ӧ2A(g) ![]() B(g)+C(g)��ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A(g)��20sʱ��ø���ֵ����ʵ������±�������˵����ȷ������ ��
B(g)+C(g)��ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A(g)��20sʱ��ø���ֵ����ʵ������±�������˵����ȷ������ ��
���� | A(g) | B(g) | C(g) |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
A����Ӧǰ20s��ƽ������Ϊv(A)=0.6mol��L��1��S��1
B��20sʱ������Ӧ���ʵ����淴Ӧ����
C����ƽ��ʱ��A(g)��ת����Ϊ100%
D���������¶ȣ�ƽ�ⳣ������Ϊ0.5����Ӧ����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������28Ni�������ʻ�������[����Ԫ�غ�һ����̼��CO�����Է����γɵ�һ�������]�������������[�ܿ���Ķ�����ա�������ͷ�������H2���ĺϽ�]��������;�㷺��
��1��Niԭ�ӻ�̬��������Ų�ʽΪ_________________��
��2��Ni(CO)4�����Ļ��ϼ�Ϊ_____________��д����CO��Ϊ�ȵ���������Է��ӡ���һ����λ����ɵ������ӡ���һ����λ����ɵ������Ӹ�һ����__________��_____________��___________��
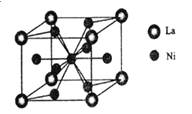
��3��һ�ִ���Ͻ��������磨La����ɣ��侧���ṹ��ͼ��ʾ����þ���Ļ�ѧʽΪ_________��
��4�����з�Ӧ����������Ni2+����д����һ����Ļ�ѧʽ__________��
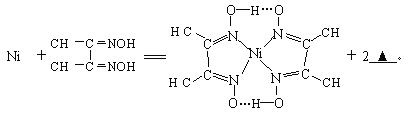
��Ni2+��λ��Nԭ����_________������������д��ڵĻ�ѧ����__________������ţ���
A���ۼ� B���Ӽ� C��λ�� D������ E���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com