
【题目】镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。
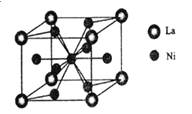
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
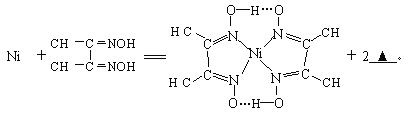
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
【答案】(1)[Ar]3d84s2 (2)0 N2、NO+、CN-(3)LaNi5(4)H+ 4 ACE
【解析】
试题分析:(1)Ni的原子序数为28,根据构造原理可写出电子排布式为:1s22s22p63s23p63d84s2或[Ar]3d84s2;
因此,本题正确答案是:1s22s22p63s23p63d84s2或[Ar]3d84s2;
(2)CO为分子,化合价为0,所以镍的化合价为0;CO含有2个原子14个电子,所以CO互为等电子体的中性分子、带一个单位正电荷阳离子、带一个单位负电荷阴离子分别为:N2、NO+、CN-;因此,本题正确答案是:0;N2;NO+;CN-;
(3)该晶胞中La原子个数=8×1/8=1,Ni原子个数=1+8×1/2=5,化学式为LaNi5(或Ni5La),因此,本题正确答案是:LaNi5(或Ni5La);
(4)由质量守恒与电荷守恒可以知道,Ni2+![]() ═
═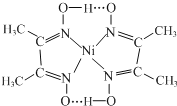 +2H+;
+2H+;
Ni含有空轨道、N原子含有孤电子对,所以配位键由N原子指向Ni原子,有4个配位键;该配合物中N-O中O原子和-OH中氢原子形成氢键,该配合物分子中配位键、氢键为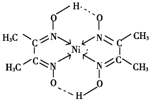 ,除此之外还含有共价键;因此,本题正确答案是:H+;4;ACE.
,除此之外还含有共价键;因此,本题正确答案是:H+;4;ACE.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应aA(g) +bB(g)![]() cC(g)( △H <0)在等容条件下进行。改变其他反应条件,在I、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)( △H <0)在等容条件下进行。改变其他反应条件,在I、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a:b:c为 ;
(2)A的平均反应速率vI (A)、vⅡ(A)、vⅢ(A)从大到小排列次序为 ;
(3)B的平衡转化率![]() I (B)、
I (B)、![]() Ⅱ(B)、
Ⅱ(B)、![]() Ⅲ (B)中最小的是 ,其值是 ;
Ⅲ (B)中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“ >、=、< ”)判断的理由是 ;
(6)达到第三阶段平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出 A、B、C)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是____________,写出“还原”时反应Ⅱ的离子方程式:___________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)。
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.2 | 3.5 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有K2SO4、Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1,SO42-的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度为( )
A.0.1 mol·L-1 B.0.15 mol·L-1
C.0.2 mol·L-1 D.0.25 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950 mL,111.2 g B.500 mL,117 g
C.1 000 mL,117 g D.1 000 mL,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知4NH3+5O2![]() 4NO+6H2O(g),若化学反应速率分别是用v(NH3)、v(O2)、v(NO)、v(H2O)(单位mol/(L·min))表示,则正确的关系是()
4NO+6H2O(g),若化学反应速率分别是用v(NH3)、v(O2)、v(NO)、v(H2O)(单位mol/(L·min))表示,则正确的关系是()
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与稀盐酸反应制CO2,实验过程记录如下图所示。根据分析、判断,正确的是( )
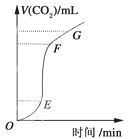
A.OE段表示反应速率最快
B.EF段表示反应速率最快,收集的CO2最多
C.FG段表示收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.6g纯净金属钠在干燥空气中被氧化后,得到7.0g固体,由此可判断其氧化产物是
A.只有Na2O B.只有Na2O2 C.Na2O2和Na2O D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有原子序数依次增大的A、B、C、D、E、F六种元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间,两两皆能反应且均能生成盐和水。D和E各有如下表的电子层结构。
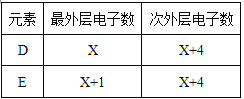
按要求填空:
(1)A的元素符号 ,质子数比中子数少2的B元素的一种核素的符号 ,F的原子结构示意图 。
(2)D和E两者的氢化物稳定性较强的是 (填化学式)。
(3)C单质与A元素的最高价氧化物对应的水化物反应的离子方程式为 。
(4)工业上制取单质D的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com