
����Ŀ������������Ҫ��FeS2��SiO2�ȣ��Ʊ�Ī���ε��������£�

��֪������ԭ��ʱ��FeS2��H2SO4����Ӧ��Fe3+ͨ����Ӧ��ԭ�����з�Ӧ�����£�
2Fe3++ FeS2=2S��+3Fe2+
��1������ԭ��ʱ��pH���˹��ߵ�ԭ����____________��д������ԭ��ʱ��Ӧ������ӷ���ʽ��___________��
��2��ʵ���á���ԭ��ʱ��Ӧ���б���ԭ��Fe3+�����ʵ���֮��Ϊ2��7�����㡰��ԭ������ҺFe2+��Ũ�ȼ���ȷ����������(NH4)2SO4��������Һ����仯���Բ��ƣ���
���� | ����Ũ�ȣ�mol��L��1�� | |
��ԭǰ | ��ԭ�� | |
SO42�� | 3.2 | 3.5 |
Fe2+ | 0.15 | |
��3����ȡ23.52g����Ī���Σ�����ˮ�����Һ���ֳ����ȷݡ�һ�ݼ���������BaCl2��Һ���õ���ɫ����13.98g����һ����0.2000mol/LK2Cr2O7������Һ�ζ�����Cr2O72-ǡ����ȫ����ԭΪCr3+ʱ��������Һ�����Ϊ25.00mL����ȷ��Ī���εĻ�ѧʽ__________��
���𰸡���1��pH����ʱ��Ԫ�ؽ��������²��ʽ���FeS2+14Fe3++8H2O=15Fe2++2SO42��+16H+
��2��3.30 ��3��FeSO4��(NH4)2SO4��6H2O
��������
�����������������Ҫ��FeS2��SiO2�ȣ��ڿ����б��գ��ö����������������������������ȹ��壬�������ܽ⣬���˳�ȥ�������裬����������Һ����������Һ���ټ���������FeS2�������ӻ�ԭΪFe2+��ͬʱ����S���������ˣ���������S����������Һ����Ҫ�������������Ļ����Һ��������Һ�м�������泥���������Ũ�����½ᾧ�����ˣ�ϴ�ӣ�����ɵ�Ī���Σ�
��1����������ķ�������֪��������ԭ��ʱ���������������������pH����ʱ��Ԫ�ؽ��������²��ʽ��ͣ�����ԭ��ʱFeS2�������ӻ�ԭΪFe2+��ͬʱ����S���������Է�Ӧ������ӷ���ʽΪFeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+����ˣ�������ȷ���ǣ�pH����ʱ��Ԫ�ؽ��������²��ʽ��ͣ�FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+��
��2�����ݱ������ݿ���֪������Ӧ���������Ũ�ȱȷ�Ӧǰ������3.50molL-1-3.20molL-1=0.3molL-1�����ݷ�ӦFeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+����֪������Ӧ������Fe3+�����ʵ���Ϊ2.1mol�����ɵ�Fe2+���ʵ���Ϊ2.25mol����Ϊ���б���ԭ��Fe3+�����ʵ���֮��Ϊ2��7���������ĵ������ӵ����ʵ���Ϊ0.6mol�����ݷ�Ӧ2Fe3++FeS2=2S��+3Fe2+����֪��������Fe2+���ʵ���Ϊ0.9mol�����Է�Ӧ����Һ��Fe2+���ʵ���Ϊ2.25mol+0.9mol+0.15mol=3.30mol����ˣ�������ȷ���ǣ�3.30��
��3����ȡ23.52g����Ī���Σ�����ˮ�����Һ���ֳ����ȷݣ�һ�ݼ���������BaCl2��Һ���õ���ɫ�������ᱵ������Ϊ13.98g�������ʵ���Ϊ13.98g/233g/mol=0.06mol������n��SO42-��=0.06mol��
��һ����0.2000molL-1K2Cr2O7������Һ�ζ�����Cr2O72-ǡ����ȫ����ԭΪCr3+ʱ��������Һ�����Ϊ25.00mL���������⣬
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n��Fe2+�� 0.2000molL-1��0.025L������n��Fe2+��=0.005 mol��6=0.03mol�����ݵ���غ㣺n��NH4+��+2n��Fe2+��=2n��SO42-����n��NH4+��=0.06mol��n��H2O��=[��23.52g/2��-0.06mol*96g/mol-0.03mol*56g/mol-0.06mol*18g/mol]/18g/mol=0.18mol������n��SO42-����n��Fe2+����n��NH4+����n��H2O��=0 06 mol��0 03 mol��0 06mol��0 18 mol=2��1��2��6������Ī���εĻ�ѧʽΪ��NH4��2Fe��SO4��26H2O[��NH4��2SO4FeSO46H2O]����ˣ�������ȷ���ǣ���NH4��2Fe��SO4��26H2O[��NH4��2SO4FeSO46H2O]��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧѡ��2 -��ѧ�뼼δ��
I.ij���̿������Ҫ�ɷ���MnCO3��MnO2��FeCO3��SiO2 ��A12O3�ȡ���֪FeCO3��MnCO3������ˮ��һ������������Ĥ��ⷨ���¼��������ڴ�̼���̿�����ȡ�����̣���Ҫ����ת����ϵ���£�
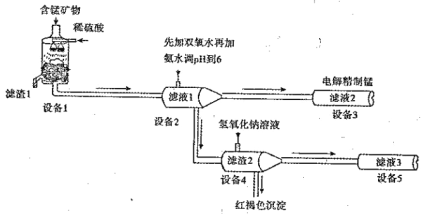
(1)�豸���з�Ӧ����Һ1����Ԫ��ֻ��Mn2+����ʽ���ڣ�������1��Ҳ��MnO2�� ����1����Ҫ�ɷ��� (�ѧʽ����
(2)�豸1�з���������ԭ��Ӧ�����ӷ���ʽ�� ��
(3)�豸2�м�����˫��ˮ�������� �����ʵ�鷽��������Һ2���Ƿ����Fe2+: ��
(4)�豸4�м����������������Һ�����������ܽ⣬�û�ѧƽ���ƶ�ԭ������ԭ�� ��
��5���豸3����������Ĥ����ȡ�����̵ĵ��װ����ͼ��

�����װ���м�ͷ��ʾ��Һ���������ƶ��ķ���;��A�缫��ֱ����Դ�� ����ʵ�������У�������ϡ����Ϊ���Һ�������ĵ缫��ӦʽΪ__ ___��
���ù���֮���Բ��������ӽ���Ĥ����Ϊ�˷�ֹMn2+ ������������������Ӧ����MnO2�����Դ�˷ѣ�д���ø���Ӧ�ĵ缫��Ӧʽ ��

II.��ͭ�����Ҫ�ɷ���Cu2S��FeS,��������Al2O3��SiO2���ʡ��ɱ�ͭ��ұ������ͭ����������:
��֪�����ӳ����ķ�Χ���±�
���� | Fe3+ | Fe2 + | Cu2+ |
��ʼ����pH | 1.9 | 7.0 | 6.7 |
������ȫpH | 3.4 | 9.0 | 10.0 |
��ش��������⣺
��1������ͭ������Ŀ������߽����ʣ�����һ����߽����ʵĴ�ʩ�� ��
��2����Һ1�ijɷ��� ����������ͨ��������CO2���������ij����� ����ʱ��Һ�е����ʽ���� ��
��3������1����H2O2��ϡH2SO4����Һ��������ֻ��SO42-��������������Cu2+ ��F3+����ù��̵����ӷ���ʽΪ: ��
��4)��Һ2���ڵ�pH��ΧΪ ��
��5���Ժ��ɫ��������ϴ�Ӳ����ﴦ�������Եõ�������Fe(OH)3���������Ʊ���ɫ����Fe2O3��������ɫ�����Ƿ�ϴ���ķ����� ��
(6)�ö��Ե缫����Һ3���е�⣬���CuSO4��Һ�Ļ�ѧ����ʽΪ�� ����������������״����44.8 L���������������������������֮��Ϊ1: 1ʱ����������ͭ������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��ơ��Ȼ������Ȼ��������Ȼ������Ȼ�þ������Һ��ֻ��һ���Լ����ܼ������������Լ���
A��KSCN B��BaCl2 C��NaOH D��HCI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Ӧ2A(g) ![]() B(g)+C(g)��ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A(g)��20sʱ��ø���ֵ����ʵ������±�������˵����ȷ������ ��
B(g)+C(g)��ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A(g)��20sʱ��ø���ֵ����ʵ������±�������˵����ȷ������ ��
���� | A(g) | B(g) | C(g) |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
A����Ӧǰ20s��ƽ������Ϊv(A)=0.6mol��L��1��S��1
B��20sʱ������Ӧ���ʵ����淴Ӧ����
C����ƽ��ʱ��A(g)��ת����Ϊ100%
D���������¶ȣ�ƽ�ⳣ������Ϊ0.5����Ӧ����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)�Ͱ��ǵ������ֳ���������ڿ�ѧ�������������й㷺Ӧ�ã��ش��������⣺
(1)N2H4��Nԭ�Ӻ��������ﵽ8�����ȶ��ṹ��д��N2H4�Ľṹʽ��___________��
(2)ʵ���������ֹ�����ȡNH3�ķ�Ӧ��ѧ����ʽΪ_____________��
(3)NH3��NaClO��Ӧ�ɵõ���(N2H4)���÷�Ӧ�Ļ�ѧ����ʽΪ_____________��
(4)��һ����ȼ�ϵ����һ�ּ��Ի�����أ��õ�طŵ�ʱ�������ķ�ӦʽΪ_____________��
(5)��ҵ�������ص�ԭ������NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]��Ӧ�Ļ�ѧ����ʽΪ2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
T/�� | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
���ʱ��H_________0(���������������=��)��
����һ���¶Ⱥ�ѹǿ�£���ԭ�����е�NH3��CO2�����ʵ���֮��(��̼��)\frac{n(NH_{3})}{n(CO_{2})}=x����ͼ�ǰ�̼��(x)��CO2ƽ��ת����(��)�Ĺ�ϵ��������x����������ԭ����_____________��ͼ��A�㴦��NH3��ƽ��ת����Ϊ___________��
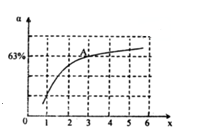
(6)�ں��º����ܱ������а��ռס��ҡ������ַ�ʽ�ֱ�Ͷ�ϣ�������Ӧ��N2(g)+3H2(g)2NH3(g)����ü�������H2��ƽ��ת����Ϊ40%��
n(N2) | n(H2) | n(NH3) | |
�� | 1mol | 3mol | 0mol |
�� | 0.5mol | 1.5mol | 1mol |
�� | 0mol | 0mol | 4mol |
���ж��������з�Ӧ���еķ�����_____________(����������)�ƶ���
�ڴ�ƽ��ʱ���ס��ҡ�����������NH3�����������С˳��Ϊ_____________��
��6�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����д���÷�Ӧ�Ļ�ѧ����ʽ�� ����ѧ�����ô�ԭ������Ƴɰ���һ����ȼ�ϵ�أ���ͨ�백���ĵ缫��
��7��һ�������£�ij�ܱ������з�����Ӧ��4NH3��g��+5O2��g��![]() 4NO��g��+6H2O��g������һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ������д�ʩ�пɲ��õ��� ������ĸ���ţ���
4NO��g��+6H2O��g������һ��������ܱ������У�Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ������д�ʩ�пɲ��õ��� ������ĸ���ţ���
a������ѹǿ b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����
��8�����ij��ˮ�ĵ���̶�Ϊ1%��Ũ��Ϊ0.01 mol/LMgCl2��Һ�μ���ˮ����ʼ��������ʱ(��������Һ����仯)����Һ�е�NH3��H2O��Ũ��Ϊ {��֪Ksp[Mg(OH)2]=4.0��10-12]}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016�꣬�ҹ������Ŷӿ�������úΪԭ�Ϻϳ���̬ϩ������;��������˵���������
A. ú��������Һ���������仯
B. ú�ĸ������ڸ������������½��е�
C. ����ȼ��ú̿�������������Ҫԭ��
D. ��չ��ú���͡����̿ɼ��ٶ�ʯ�Ͳ�Ʒ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ľṹ��ʽ��ͼ��ʾ�������й�˵����ȷ���ǣ� ��
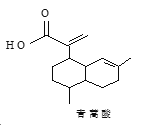
A��������ķ���ʽΪC15H20O2
B��1mol������������3molH2�ӳ�
C����������![]() ��Ϊͬ���칹��
��Ϊͬ���칹��
D������������-CHO��-OH����������6�ֲ�ͬ��ѧ��������������ͬ���칹��ֻ��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������28Ni�������ʻ�������[����Ԫ�غ�һ����̼��CO�����Է����γɵ�һ�������]�������������[�ܿ���Ķ�����ա�������ͷ�������H2���ĺϽ�]��������;�㷺��
��1��Niԭ�ӻ�̬��������Ų�ʽΪ_________________��
��2��Ni(CO)4�����Ļ��ϼ�Ϊ_____________��д����CO��Ϊ�ȵ���������Է��ӡ���һ����λ����ɵ������ӡ���һ����λ����ɵ������Ӹ�һ����__________��_____________��___________��
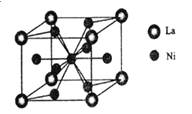
��3��һ�ִ���Ͻ��������磨La����ɣ��侧���ṹ��ͼ��ʾ����þ���Ļ�ѧʽΪ_________��
��4�����з�Ӧ����������Ni2+����д����һ����Ļ�ѧʽ__________��
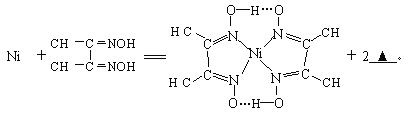
��Ni2+��λ��Nԭ����_________������������д��ڵĻ�ѧ����__________������ţ���
A���ۼ� B���Ӽ� C��λ�� D������ E���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1 g������ȫȼ������ˮ����ʱ�ų�����121 kJ����������1 mol O==O����ȫ����ʱ��������496 kJ��ˮ������1 mol H��O���γ�ʱ�ų�����463 kJ����������1 mol H��H������ʱ��������Ϊ
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com