
【题目】肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:___________.
(2)实验室用两种固体制取NH3的反应化学方程式为_____________.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_____________.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为_____________.
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变△H_________0(填“>”、“<”或“=”).
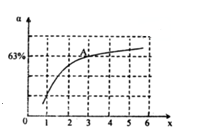
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)\frac{n(NH_{3})}{n(CO_{2})}=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是_____________.图中A点处,NH3的平衡转化率为___________.
(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)2NH3(g),测得甲容器中H2的平衡转化率为40%.
n(N2) | n(H2) | n(NH3) | |
甲 | 1mol | 3mol | 0mol |
乙 | 0.5mol | 1.5mol | 1mol |
丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是_____________(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为_____________。
(6)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式: ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是
(7)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(8)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为 {已知Ksp[Mg(OH)2]=4.0×10-12]}
【答案】(1)![]()
(2)![]()
(3)![]()
(4)![]()
(5)①< ;②c(NH3)增大,平衡正向移动;42%
(6)4NH3+3O2![]() 2N2+6H2O, 负极 2NH3+6OH-6e―= N2+6H2O (7)C (8)0.002 mol/L
2N2+6H2O, 负极 2NH3+6OH-6e―= N2+6H2O (7)C (8)0.002 mol/L
【解析】
试题分析:(1)联氨N2H4中N原子与其它三个原子成键,达到8电子稳定结构,结构式为![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
;
(2)制取氨气的反应物是氯化铵与熟石灰,生成物是氯化钙、水和氨气:![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
;
(3)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:![]() ,
,
因此,本题正确答案是:![]() ;
;
(4)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() .
.
(5)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,因此,本题正确答案是:<;
②2NH3(g)+CO2(g)CO(NH2)2(l)+H2O(l),图象分析判断,增大氨气浓度平衡正向进行,因此,本题正确答案是:c(NH3)增大,平衡正向移动;A点处x=3,原料气中的NH3和CO2的物质的量之比为3,二氧化碳转化率为63%,假设氨气为3mol,二氧化碳为1mol,则反应的二氧化碳为0.63mol,根据化学方程式2NH3(g) + CO2(g) CO(NH2)2(l) + H2O(l)反应的氨气为1.26mol,NH3的平衡转化率=1.26mol/3mol*100%=42% 因此,本题正确答案是:42%;
(6)①甲、乙、丙三种方式分别投料形成的平衡不但等效也等同,甲容器平衡时N2、H2、NH3的物质的量分别为:0.6mol、1.8mol、0.8mol,则乙容器中反应进行的方向是逆向移动,因此,本题正确答案是:逆向;②根据甲、乙、丙三种方式分别投料形成的平衡不但等效也等同,各物质的体积分数相等,因此,本题正确答案是:甲=乙=丙;
(7)加大反应物浓度,平衡正向移动


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于乙烯和乙烷的说法中,不正确的是( )
A. 乙烯属于不饱和链烃,乙烷属于饱和链烃
B. 乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,所有原子不在同一平面上
C. 乙烯分子的C=C键中有一个键容易断裂
D. 乙烯分子的C=C键都容易断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使溶液中的Ag+、Mg2+、Ba2+三种离子逐一形成沉淀析出,选择的试剂及加入的顺序正确的是( )
A. NaOH―→NaCl―→Na2CO3
B. NaCl―→Na2CO3―→NaOH
C. HCl―→Na2CO3―→NaOH
D. NaCl―→NaOH―→Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电了数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
A. Y的最高价氧化物对成水化物的酸性比W的强
B. W的气态氢化物比X的稳定
C. 离子半径的大小顺序:r(w)>r(X)>r(Y)>(Z)
D. XY2与ZY2中的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
2Fe3++ FeS2=2S↓+3Fe2+
(1)“还原”时,pH不宜过高的原因是____________,写出“还原”时反应Ⅱ的离子方程式:___________。
(2)实验测得“还原”时反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7。计算“还原”后溶液Fe2+的浓度即可确定后面所加(NH4)2SO4的量(溶液体积变化忽略不计)。
离子 | 离子浓度(mol·L-1) | |
还原前 | 还原后 | |
SO42- | 3.2 | 3.5 |
Fe2+ | 0.15 | |
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份。一份加入足量的BaCl2溶液,得到白色沉淀13.98g;另一份用0.2000mol/LK2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL。试确定莫尔盐的化学式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(L·min) B.v(B)=0.3 mol/(L·min)
C.v(C)=0.8 mol/(L·min) D.v(D)=1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950 mL,111.2 g B.500 mL,117 g
C.1 000 mL,117 g D.1 000 mL,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃时,2mol乙醇(C2H5OH)在氧气中完全燃烧放出的热量为2733.6kJ,写出表示乙醇燃烧热的热化学方程式 。
(2)利用乙醇的燃烧反应以氢氧化钠作电解质溶液设计一个燃料电池,则通入氧气的一极为 (填“正极”“负极”),负极的电极反应式为 。
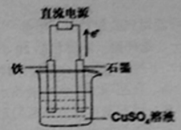
(3)在如图所示装置中,石墨电极的电极反应式为 。如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是 (填化学式),其质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com