
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙呈红色的溶液中:Na+、Ba2+、Cl-、NO3-
B. c( OH-) <![]() 的溶液中:Na+、Ca2+、ClO-、NO3-
的溶液中:Na+、Ca2+、ClO-、NO3-
C. 含有大量Fe( NO3)2 的溶液中:H+、NH4+、Cl-、SO42-
D. 水电离的c( H+)= 1× 10 -13mol/L的溶液中:K+、Mg2+、Br-、CH3COO-
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g) ![]() 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为____________。
(2)300 ℃时,2NOCl(g) ![]() 2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
序号 | c(NOCl)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=________,k=________。
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:反应开始到10 min时Cl2的平均反应速率v(Cl2)=________ mol·L-1·min-1。
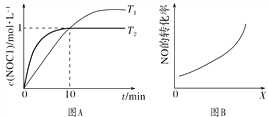
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[温度、压强、![]() 、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。
、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图所示实验装置,回答下列问题。
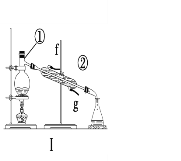
(1)写出上图中仪器的名称:①____________,②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器___________;②中进水口是________(填“f”或“g”)。
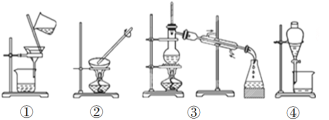
(3)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水:______; b.分离氯化钠和水:______;
c.分离碳酸钙和水:______; d.分离植物油和水:______。
(4)装置②中玻璃棒的作用是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的分子式为C2H2,B是合成塑料的单体,C的相对分子质量为78,M是一种具有广谱高效食品防腐作用的有机物,以A为原料合成B和M的路线如图所示。
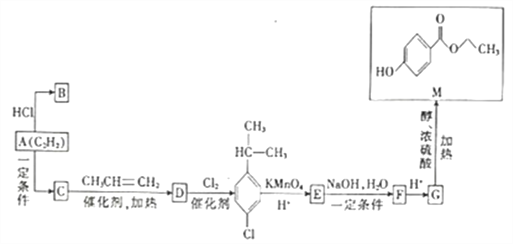
(1)C→D的反应类型为___________,B的结构简式为___________。
(2)写出E→F的化学方程式:_______________________________。
(3)G中的含氧官能团的名称是_______________,写出由G在一定条件下反应生成高分子化合物的化学反应方程式:_______________________________________。
(4)M的同分异构体有多种,写出四种满足以下条件的同分异构体的结构简式:___________、___________、___________、___________。
①能发生银镜反应
②含有萃环且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上同时连接两个-OH的结构不稳定)
(5)对甲基苯酚![]() 是重要的有机化工中间体,写出以乙炔、丙炔为原料(无机试剂任选)制备对甲基苯酚的合成路线:_________________________________________________。
是重要的有机化工中间体,写出以乙炔、丙炔为原料(无机试剂任选)制备对甲基苯酚的合成路线:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料。
(1)不同温度、压强下.合破氦平衡休系NH3的物质的量分数如图(N2和H2的起始物质的量之比为1:3)。
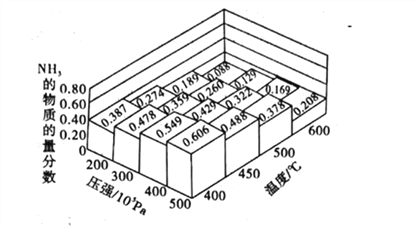
①分析图中数据,升商温度,该反应的平衡常数K值____(填“增大”“城小”或“不变”)。
②下列关于合成氨的说法正确是_____(填序号)。
A.工业上合成氨,为了提高氨的含量压强越大越好
B.使用催化剂可以提高氨气的产率
C.合成氨反应△H<0、△S<0,该反应高温条件下一定能自发进行
D.减小n(N2):n(H2)的比值,有利于提高N2的转化率
③如果开始时向密闭容器中投入1.0molN2和3.0molH2,则在500C、3×107Pa条件下达到平衡时N2的平衡转化率=_______。(保留两位有效数字)
(2)以氨气代替氢气研发氨燃料电池是当前科研的一一个热点。氨燃料电池使用的电解质溶液是KOH溶液。该电池负极的电极反应式为_________________。
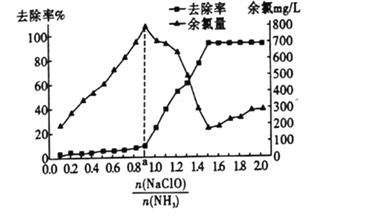
(3)NH3也是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应I:NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反应II:NH2Cl(aq)+HClO(aq)=NHCl(aq)v △H2=bkJ/mol;
反应III:2NHCl2(aq)+H2O(l)=N2(g)+HClO(aq)+3HCl(aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2(g)+ H2O(l) △H=________kJ/mol
②已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件不变的情况下,改变![]() 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
A.反应I、I I B.反应I
③除氨氮过程中最佳的![]() 值约为______________。
值约为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双级膜电渗析解离NaCl溶液制备酸碱的原理如图所示,为提高海水淡化的附加值提供了新的技术途径。已知BP为双级膜,A、C阴阳膜界面可以解离H+和OH-,下列说法正确的是( )。
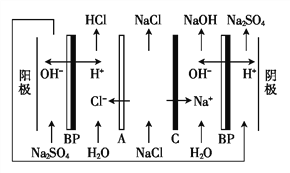
A. 根据Na+的移动方向可知,C为阴离子交换膜
B. 当电路中通过1 mol电子的电量时,会有1 mol H2生成
C. 阳极发生的电极反应为4OH-+4e-![]() O2↑+2H2O
O2↑+2H2O
D. 该方法在淡化海水时可以得到H2、O2、NaOH、HCl等物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com