
【题目】双级膜电渗析解离NaCl溶液制备酸碱的原理如图所示,为提高海水淡化的附加值提供了新的技术途径。已知BP为双级膜,A、C阴阳膜界面可以解离H+和OH-,下列说法正确的是( )。
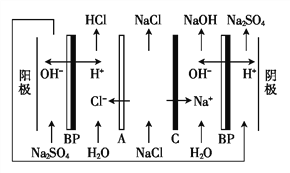
A. 根据Na+的移动方向可知,C为阴离子交换膜
B. 当电路中通过1 mol电子的电量时,会有1 mol H2生成
C. 阳极发生的电极反应为4OH-+4e-![]() O2↑+2H2O
O2↑+2H2O
D. 该方法在淡化海水时可以得到H2、O2、NaOH、HCl等物质
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】已知苯分子为平面正六边形的结构,下列说法中错误的是( )
A. 苯分子中碳原子间形成的碳碳键完全相同
B. 苯分子中形成共价键的夹角都是120°
C. 苯分子中6个碳原子位于同一平面内
D. 苯分子中的碳原子与氢原子不在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙呈红色的溶液中:Na+、Ba2+、Cl-、NO3-
B. c( OH-) <![]() 的溶液中:Na+、Ca2+、ClO-、NO3-
的溶液中:Na+、Ca2+、ClO-、NO3-
C. 含有大量Fe( NO3)2 的溶液中:H+、NH4+、Cl-、SO42-
D. 水电离的c( H+)= 1× 10 -13mol/L的溶液中:K+、Mg2+、Br-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是(已知硝酸可将Fe2+氧化)( )
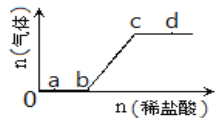
A. a点对应的溶液中:Na+、OH-、SO42-、NO3- B. b点对应的溶液中:K+、Ag+、MnO4-、NO3-
C. c点对应的溶液中:Fe2+、Ca2+、NO3-、Cl- D. d点对应的溶液中:K+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
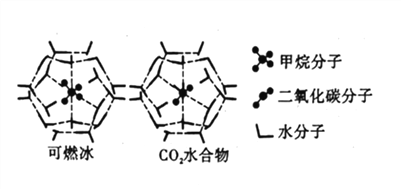
【题目】20世纪末,科学家发现海底存在大量天然气水合物晶体。在天然气水合物晶体中,有甲烷、氧气、二氧化碳、硫化氢、稀有气体等,它们在水合物晶体里是装在几个水分子构成的笼内,因而又称为笼状化合物。
(1)区分晶体和非晶体最可靠的科学方法是___________。
(2)基态C原子中,核外电子占据的最高能层的符号是______,该能层最高能级电子的电子云轮廓形状为________。
(3)H2S分子中中心原子的杂化方式为_______。H2S中H-S-H的键角比CH4中H-C-H的键角_______(填“大”“小”或“相等”)。
(4)CH4、CO2与H2O形成的笼状结构如图所示,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
物质 | 分子直径(nm) | 分子与H2O的结合能(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中存在的作用力有_____________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表分析,该设想的依据是_____________。
(5)已知稀有气体化合物XeF2的空间构型如图所示,据此判断中心原子Xe的杂化方式为_______(填序号)。
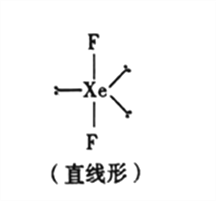
A.sp杂化 B.sp2杂化 C.sp3杂化 D.sp3d杂化
(6)氧气的晶体结构与CO2相似,晶体中若以一个分子为中心,其周围有_____个紧邻的分子,若紧邻的两个分子之间距离为anm,列式表示氧气晶体的密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是
A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D. 如图所示是树林中的晨曙,该反应与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的是( )
A.K+、Cl-、CO32-、Ca2+B.H+、Fe2+、NO3-、Na+
C.Na+、NH4+、Cl-、NO3-D.NH4+、SO42-、K+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 9gD2O中含有的电子数为5NA
B. 氢氧化铁胶体带正电荷。用含0.1mol的FeCl3溶液制成的氢氧化铁胶体中,胶粒数小于0.1NA
C. 常温下,7.8gNa2O2与100mL0.05mol/L的HCl溶液反应,产生的气体体积大于1120mL
D. 0.1mol/LNa2CO3溶液中:H2CO3、CO32-、HCO3-物质的量之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:
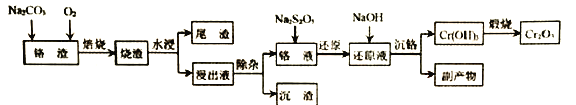
已知:Ksp[Mg(OH)2]=1.2×10-11,Ksp [Cr(OH)3]=6.4×10-31
(1)若以氧化物形式表示矿物的组成,Fe2SiO4可表示为______。
(2)焙烧时通入氧气的作用是 ______。
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43- 、AsO43- 、SiO32-反应,分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。
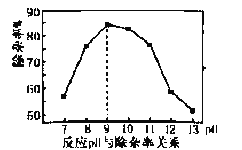
①反应过程控制溶液pH为9,若pH>9除杂率降低的原因是 ______。
②反应的温度控制在80℃左右,温度不宜太高的主要原因是_______。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)
①完成“还原”反应的离子方程式:_____________
![]()
②已知铬液中c(Cr2O72- )=0.32 mol/L ,为了不使还原过程产生Cr(OH)3沉淀,应 控制反应过程pH不大于 _____。
(5)“沉铬”主要副产物为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com