
【题目】石油分馏塔装置示意如图。a、b、c分别为石油分馏产品。下列说法正确的是

A. 在a、b、c三种馏分中,a的熔点最高
B. 分馏产品的沸点:a>b>c>柴油>重油
C. 在a、b、c三种馏分中,c的平均相对分子质量最大
D. a、b、c、柴油、重油都是纯净物
【答案】C
【解析】在分馏塔中,位置越高温度越低,石油蒸气在上升途中会逐步液化、冷却及凝结成液体馏分,易挥发的沸点较低、较轻的馏分先出来,一定在最高处,也就是说分馏塔中出口越低,分馏出的馏分的沸点越高;a先分馏出来,c较a、b最后分馏出来,故熔沸点高低顺序为a<b<c,熔沸点越高,烃中含碳原子数越多,平均分子量越大,即相对分子质量a<b<c。A.熔沸点高低顺序为a<b<c,a处的馏分为汽油,故a的熔点最低,故A错误;B.分馏塔中出口越低,分馏出的馏分的沸点越高,故熔沸点高低顺序为a<b<c<柴油<重油,故B错误;C.a先分馏出来,c较a、b最后分馏出来,故熔沸点高低顺序为a<b<c,熔沸点越高,烃中含碳原子数越多,平均分子量越大,即相对分子质量a<b<c,故C正确;D.从分馏塔各个出口出来的馏分都为混合物,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】(12分)高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是 。
(2)步骤③中肼(N2H4)将过量铬酸(CrO3)还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式 。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100L锅炉水(含氧气8g/L)的溶解氧,需要肼的质量为 。
Ⅱ.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程) (精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备少量AlCl3。已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:

(1)a仪器的名称为_______;A装置中反应的化学方程式为_______。
(2)试剂b为_______;C装置的作用为_______。
(3)所用d导管较粗的原因是_______;E装置的作用为_______。
(4)F装置的作用为_______。
(5)若上图中的D、E装置改为下面装置,D装置中的现象为_______;用离子方程式表示E中的现象变化_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常溫下,浓度均为1.0mol/L的HX溶液、HY溶液、HY和 NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是( )
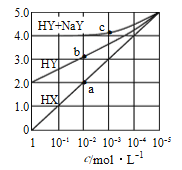
A. HX是强酸,溶液每稀释10倍,pH始终增大1
B. 常温下HY的电离常数为1.0×10-4
C. 溶液中水的电离程度:a点大于b点
D. c 点溶液中:c(Na+)>c(Y-)>c(HY)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)以下为工业从海水中提取液溴的流程图:

已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用“图1”装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞 ,打开活塞 。

(2)步骤②中可根据 现象,简单判断热空气的流速
(3)步骤③中简单判断反应完全的依据是 。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是 。
(5)步骤⑤用“图2”装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意 装置C中直接加热不合理,应改为 ,蒸馏时冷凝水应从 端进入(填“e”或“f”),图中E、F的作用是 、 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的方法不正确的是 ( )
A. 铜粉中混有铁粉:加入过量盐酸充分反应,过滤
B. CO2中混有HCl:将其通入NaOH溶液,洗气
C. NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体
D. FeCl2溶液中混有少量FeCl3:加入Fe粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
(1)用NO2表示0~2 s内该反应的平均速度___________.在第5 s时,NO2的转化率为_____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是_____________________。
(2)上述反应在第3 s后达到平衡,能说明该反应已达到平衡状态的是______。
a.单位时间内,消耗2 mol NO2的同时生成1 mol的N2O4
b.容器内压强保持不变
c.v逆(NO2)=2v正(N2O4)
d.容器内密度保持不变
(3)在2 s内,该反应_______(“吸收”或“放出”) _______热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工北上用于橡胶的硫化,查阅相关资料得到如下信息:
①干燥的氯气与硫在110℃140℃反应可得S2Cl2,S2Cl2在300℃以上完全分解。
②S2Cl2常温下为红棕色液体,沸点为137℃:S2Cl2遇水生成HCl、SO2、S。
③S的熔点为112.8 S2Cl2,沸点为444.6℃。
某班同学在实验室制备S2Cl2并探究其性质,回答下列问题:
(一)氯气的制备
(1)氯气的发生装置可以选择上图中的__________(填字母),反应的化学方程式为___________________。

(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:发生装置→__________(按气流方向,用小写字母表示)。
(二)S2Cl2的制备
将上述收集到的氯气通入下图装置,在一定温度下进行实验。

(3)证明实验中有S2Cl2生成的现象是_______________。若加热G时温度过高,在X中可能出现的现象是______________。
(4)Z中的试剂名称是__________,如果没有Z装置,可能造成的不良影响有__________。
(三)S2Cl2的性质探究
(5)取少量(二)中制得的S2Cl2于锥形瓶中,滴加足量NaOH溶液,发生反应的离子方程式为________________。若要检验反应后的溶液中存在Cl-,在滴加硝酸和硝酸银溶液之前,必须逬行的操作是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
实验步骤 | 实验现象 | 实验结论 |
| 溶液变为橙黄色 | Ⅰ________ |
| 溶液变为黄色 | 氧化性:Br2>I2 |
| Ⅱ___________ |
反思与评价:
(1)Ⅰ________;Ⅱ________。
(2)步骤①反应的离子方程式为:________。
(3)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)________。
(4)你认为上述实转设计(填“能”或“不能)____达到实验目的,理由是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com