

| A、A、B、D、E四种元素所形成的最高价含氧酸中D的酸性最强 |
| B、形成的简单阴离子半径的大小顺序为:C>B>D>E |
| C、D、E、F三种元素形成的单质中都含有共价键 |
| D、1 mo1A、B、C元素的简单氢化物中都含有10 mol电子 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
| A、三氯化铁溶液中加入铁粉Fe3++Fe═2Fe2+ |
B、过氧化钠电子式: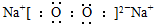 |
C、Na+结构简图: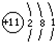 |
| D、少量氯气通入溴化亚铁溶液中2FeBr2+3Cl2═2FeCl3+2 Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沼气是一种清洁能源 |
| B、使用沼气级农民的生活带来了不便 |
| C、使用沼气作能源可以保护森林 |
| D、使用沼气是对化学能的充分利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
| B、SO2、SO3都是极性分子 |
| C、实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
| D、金属具有的光泽是金属吸收光子而发生跃迁发出特定波长的光波 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 干燥效率 | 物质 | 干燥效率 |
| MgO | 0.008 | ZnCl2 | 0.8 |
| CaO | 0.2 | ZnBr2 | 1.1 |
| A、MgO的干燥性能比CaO好 |
| B、干燥效率可能与干燥剂的阴、阳离子的半径大小有关 |
| C、MgCl2可能是比CaCl2更好的干燥剂 |
| D、上述干燥剂中阳离子对干燥剂性能的影响比阴离子小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、②③⑥⑦ |
| C、①②④⑤ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n<0.1mol |
| B、n=0.1mol |
| C、0.1mol<n<0.15mol |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.8 | 1.24 | 1.24 |
| A、①②④⑤ | B、②⑥ |
| C、②③④⑥ | D、②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com