
| A、②③④ | B、②③⑥⑦ |
| C、①②④⑤ | D、②④⑤ |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,有白色沉淀产生,说明蛋白质发生了变性 |
| B、棉花、纸、醋酸纤维的主要成分都是纤维素 |
| C、淀粉、牛油、蛋白质都是天然高分子化合物 |
| D、油脂里饱和烃基的相对含量越大,油脂的熔点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B、依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯 |
| C、依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D、依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A、B、D、E四种元素所形成的最高价含氧酸中D的酸性最强 |
| B、形成的简单阴离子半径的大小顺序为:C>B>D>E |
| C、D、E、F三种元素形成的单质中都含有共价键 |
| D、1 mo1A、B、C元素的简单氢化物中都含有10 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
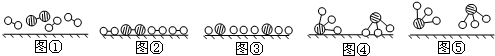
 、
、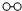 、
、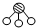 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程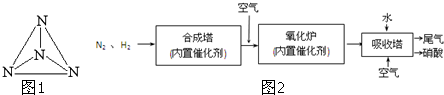
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、转移的电子数是1.204×1022 |
| B、阳极上产生112mLO2(标准状况) |
| C、溶液的浓度变化为0.08mol?L-1 |
| D、反应中有0.01molAg被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com