
【题目】足量的Zn与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但又不影响生成氢气的总量,可向盐酸中加入适量的物质是 ( )
A.NaOH固体 B.CH3COONa固体 C.NaCl晶体 D .Na2CO3固体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Fe@Fe2O3纳米线是一种新型铁基材料,在催化、生物医药、环境科学等领域具有广阔应用前景。某研究小组以赤泥(铝土矿提取氧化铝过程中产生的固体废弃物,含SiO2、Fe2O3、Al2O3)为原料,设计下列流程制备Fe@Fe2O3纳米线并探究其在水处理中的应用。
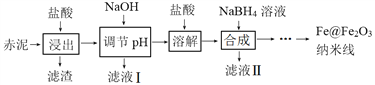
回答下列问题:
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:
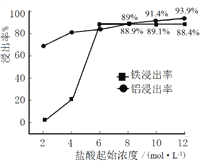
①盐酸的合适浓度为______________。
②盐酸起始浓度为2 mol·L﹣1时,铁的浸出率很低,原因是______________。
(2)已知:25℃时,Al(OH)3(s)![]() AlO2-+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为______________(设调节pH过程中溶液体积不变)。
AlO2-+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为______________(设调节pH过程中溶液体积不变)。
(3)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液Ⅱ中含B(OH)3,合成铁核的离子方程式为____________________________。
②“合成”后,经过滤、______________、______________获得Fe@Fe2O3纳米线。
(4)Fe@Fe2O3纳米线去除水体中Cr2O72-的机理是,纳米线将Cr2O72-吸附在表面并还原。在“无氧”和“有氧”条件下将纳米线分别置于两份相同的水体中,80 min后回收该纳米线,测得其表面元素的原子个数比如下表:

①在水体中Fe@Fe2O3纳米线形成的分散系是____________________________。
②样本2的实验条件是______________(填“有氧”或“无氧”)。
③已知水体中检测不到Cr(Ⅲ),样本1中Fe@Fe2O3纳米线的表面Cr(Ⅵ)的去除率为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种药物合成的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是

A. 化合物X的分子式为C16H16O6
B. 能发生加成反应、取代反应、消去反应
C. 可与FeCl3溶液发生显色反应,但不能发生氧化反应
D. 1mol化合物X最多可与5molNaOH、7mol H2、4molBr2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是

A. 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
B. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
C. 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D. 试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如下图所示:
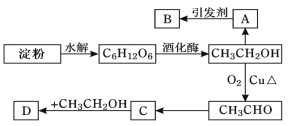
其中:A是乙烯,能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6”的名称是________,A的电子式为________,C中含有官能团名称_______。
(2) A→B反应类型______________。
(3)写出下列转化的化学方程式
C→D:_____________________,
CH3CH2OH→CH3CHO:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
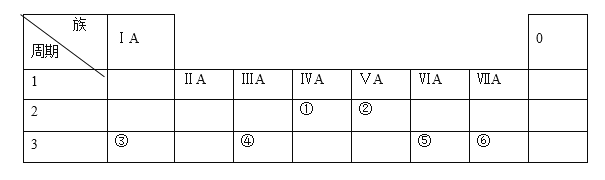
请按要求回答下列问题。
(1)元素①的元素符号是________。 元素②的单质电子式是_______。元素⑤的原子结构示意图是_______。
(2)③和⑥形成的化合物中所含化学键类型_______。
(3)HF沸点比⑥氢化物的沸点_____(高或低),原因是________。
(4)这六种元素中,位于第三周期且原子半径最小的是(填元素符号)________。
(5)这六种元素的最高价氧化物中,属于两性氧化物的元素是(填元素符号)___________。
(6)在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_________________。向上述反应后的溶液中再加入元素④的单质,发生反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

已知:几种金属离子沉淀的pH如下表。
Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10. 4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________。
A.搅拌 B.适当升高温度 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的金属阳离子为Fe3+、Mn2+,浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿,其发生反应的离子方程式为____________________,加入石灰调节溶液pH的范围为____________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________(填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________。
(5)下图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________%左右。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色环保,人人有责。下列行为或方法不符合环保要求的是( )
A.大力发展小型火力发电厂B.进行垃圾分类并进行无害化处理
C.使用无毒、可降解的食品包装材料D.改进生产工艺和设备,减少“三废”排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,则其在周期表中的位置是________________。
(2)N元素非金属性比As强,下列说法正确的是_________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的热化学方程式__________________。
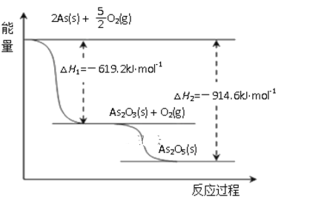
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________________。
③写出过程Ⅲ的离子方程式__________________________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com