
【题目】下列方程式书写正确的有
①向NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
②向酸性KMnO4溶液中滴加适量H2C2O4溶液,原溶液紫色褪去:2MnO4-+5H2C2O4=2Mn2-+10CO2↑+2H2O+6OH-
③碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
④NaClO溶液中CIO-的水解:CIO-+H2O=HClO+OH-
⑤酸性条件下,用H2O2将I-氧化为I2:H2O2+2I-+2H+=I2+2H2O
⑥向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
A. 1个 B. 2个 C. 3个 D. 4个
【答案】A
【解析】①向NaAlO2溶液中通入过量的CO2:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,①错误;②向酸性KMnO4溶液中滴加适量H2C2O4溶液,原溶液紫色褪去:2MnO4-+6H++5H2C2O4=2Mn2-+10CO2↑+8H2O,②错误;③碳酸的电离方程式:H2CO3![]() H++HCO3-,③错误;④NaClO溶液中CIO-的水解:CIO-+H2O
H++HCO3-,③错误;④NaClO溶液中CIO-的水解:CIO-+H2O![]() HClO+OH-,④错误;⑤酸性条件下,用H2O2将I-氧化为I2:H2O2+2I-+2H+=I2+2H2O,⑤正确;⑥向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,⑥错误,答案选A。
HClO+OH-,④错误;⑤酸性条件下,用H2O2将I-氧化为I2:H2O2+2I-+2H+=I2+2H2O,⑤正确;⑥向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,⑥错误,答案选A。


科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)为一元酸,具有较强的还原性。可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴膜),下列说法描述错误的是

A. 阳极室反应为:2H2O-4e-=O2↑+4H+
B. ab,ef均为阳膜,cd为阴膜
C. 若将稀H2SO4改为H3PO2,撤去ab膜,产品中总混有杂质的原因是:H3PO2在阳极放电而被氧化生成H3PO4
D. 通电后产品室中的H+离子向原料室迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
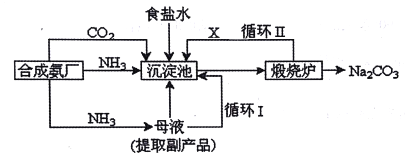
(1)沉淀池中发生的化学反应方程式是______。
(2)上述流程中X物质的分子式______。
(3)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是___(选填字母)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(4)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

请回答:
①甲中发生反应的离子方程式是________。
②乙装置中的试剂是___________。
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
④为提高二氧化碳在此反应液中被吸收的程度,实验时,须先从a管通入___气体,再从b管通入_____ 气体。
⑤装置c中的试剂为_______(选填字母)。
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)请你再写出一种实验室制取少量碳酸氢钠的方法:(用简要的文字和相关的化学反应方程式来描述):________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q、r,t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol·L-1的v溶液中:c(OH-)/c(H+)=1.0×1010。上述物质的转化关系如图所示。下列说法正确的是
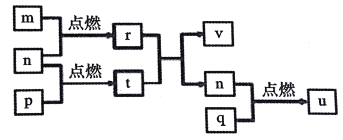
A. 原子半径的大小:W>Z>Y>X
B. Z分别与Y、W组成的化合物中化学键类型可能相同
C. v能抑制水的电离而u能促进水的电离
D. 粘有q的试管可用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将不同浓度的二元弱酸H2A和NaOH溶液等体积混合(体积变化忽略不计),设计反应后溶液的pH如下表:
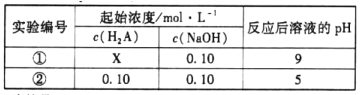
下列判断不正确的是
A.X<0.1
B.HA-的电离程度大于水解程度
C.将实验①所得溶液加水稀释后,c(A2-)/c(HA-)变大
D.实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辣椒中含辣椒素,局部应用可助减轻疼痛。辣椒素酯类化合物的结构可以表示为: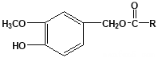 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
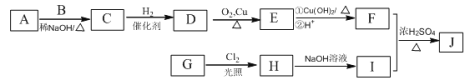
已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰,峰面积比分别为9:1和3:1;
②化合物J的分子式为C15H22O4;
③
回答下列问题:
(1)G中含有的官能团有 、 。
(2)由C生成D的反应类型为 ,D的化学名称为 。
(3)①的化学方程式为 。
(4)J的结构简式为 。
(5)G的同分异构体中,苯环上的一氯代物只有一种的共有 种(不含立体异构),核磁共振氢谱显示2组峰的是 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
碳 | 氮 | Y | |
X | 硫 | Z |
请回答下列问题:
(1)Z元素在周期表中的位置为________________。
(2)表中元素原子半径最大的是(写元素符号)________________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是________(填序号)。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)现有一定量的铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol·L-1 NaOH溶液和1molO2,则两种气体的分子式及物质的量分别为______________________________,生成硫酸铜物质的量为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业上增大压强以提高反应物的转化率
B.黄绿色的氯水光照后颜色变浅
C.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com