
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如右图,则原混合溶液中MgCl2与FeCl3的物质的量之比为( ) 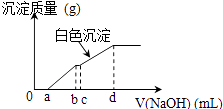
A.![]()
B.![]()
C.![]()
D.![]()
【答案】D
【解析】解:向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,首先发生反应NaOH+HCl=NaCl+H2O,即为图象中0﹣amL,沉淀的质量为0g;FeCl3只能在酸性较强的溶液中存在,当酸性减弱时,会转化为Fe(OH)3沉淀,从amL开始,bmL时沉淀完全.bmL时,溶液仍然呈酸性,到cmL时,才开始产生Mg(OH)2沉淀,
令氢氧化钠浓度为xmol/L,
Fe3+完全沉淀消耗氢氧化钠为(b﹣a)mL,结合Fe3++3OH﹣═Fe(OH)3↓可知,溶液中n(Fe3+)= ![]() ×(b﹣a)×10﹣3Lxmol/L,
×(b﹣a)×10﹣3Lxmol/L,
Mg2+完全沉淀消耗氢氧化钠为(d﹣c)mL,结合Mg2++2OH﹣═Mg(OH)2↓可知,溶液中n(Mg2+)= ![]() ×(d﹣c)×10﹣3Lxmol/L,
×(d﹣c)×10﹣3Lxmol/L,
故原混合溶液中n(MgCl2):n(FeCl3)= ![]() ×(d﹣c)×10﹣3Lxmol/L:
×(d﹣c)×10﹣3Lxmol/L: ![]() ×(b﹣a)×10﹣3Lxmol/L=
×(b﹣a)×10﹣3Lxmol/L= ![]() ,
,
故选D.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:(已知:硫不溶于水,微溶于酒精,易溶于二硫化碳、四氯化碳和苯。)

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:____________。
(2)“回收S”过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是_____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为_________________。向“滤液M”中加入(或通入)____(填字母),可得到另一种可循环利用的物质。 a.铁 b.氯气 c.高锰酸钾
(4)“保温除铁”过程中,加入CuO的目的是__________________;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是___________。
(5)洗涤硝酸铜晶体的洗涤剂可以使用下列物质中的______________。
a.酒精 b.热水 c.饱和硝酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________.
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________(填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
该样品中亚硝酸钠的质量分数为_________.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,常见化合价为+6、+5、+4,金属钼广泛用于冶金、机械制造、电子、照明及一些高科技领域。钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂,也可用于制造生物碱、油墨、化肥、钼红颜料等。如图是化工生产中制备金属钼和钼酸钠的主要流程图,已知钼精矿的主要成分为MoS2,钼酸难溶于水。
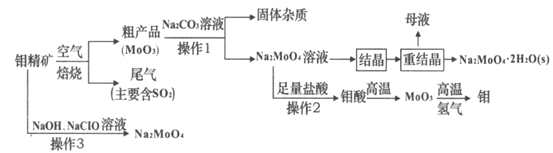
(1)MoS2焙烧时反应的化学方程式为________;产生的尾气对环境的主要危害是_______。
(2)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____。粗产品经过充分碱浸后所得的碱浸液中部分离子的浓度:c(MoO42-)=0.40mol·L-1,c(SO42-)=0.05mol·L-1。结晶前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4,开始沉淀时,SO42-的去除率为___。已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8
(3)该流程中操作2为过滤,如果在实验室模拟该操作时,发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是_______________________________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________。
(5)工业上由MoO3制备Mo粉也常用铝热反应,写出该反应的方程式_______________。
(6)操作3在碱性条件下,将钼精矿加入到足量的NaC1O溶液中,也可以制备钼酸钠。该反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于细胞中元素的叙述,错误的是
A. 硅藻和水稻细胞中Si元素的含量较多
B. 细胞中含量最多的四种元素是C、O、H和N
C. 组成细胞的化学元素没有一种为细胞特有
D. 活细胞中含量最多的化学元素是C
查看答案和解析>>
科目:高中化学 来源: 题型:
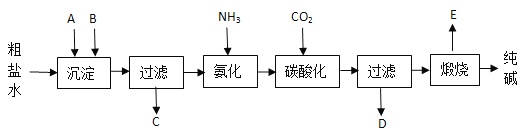
【题目】工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A_____________________ B_____________________。
(2)实验室提纯粗盐的实验操作依次为:_________
取样→________→ 沉淀 →________→______ → 冷却结晶 → _______ → 烘干 。
(3)工业生产纯碱的工艺流程中,先通氨气,再通二氧化碳的原因是________________。
(4)碳酸化时产生的现象是____________________________________,碳酸化后过滤,滤液D最主要的成分是____________(填写化学式)。
(5)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数(已知:样品质量为m1,加热后固体质量为m2),纯碱中碳酸氢钠的质量分数可表示为W(NaHCO3)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物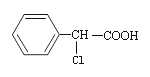 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
A. 6种 B. 9种 C. 15种 D. 19种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com