
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A. 2a=b<0 B. b>d>0 C. a<c<0 D 2c=d>0
【答案】A
【解析】A项,①H2(g)+ ![]() O2(g)=H2O(g);△H=a kJmol-1该热化学方程式的意义是:1molH2和
O2(g)=H2O(g);△H=a kJmol-1该热化学方程式的意义是:1molH2和![]() molO2完全反应生成1mol气态H2O时放出a kJ热量,物质的量与热量成正比例关系,②2H2(g)+O2(g)=2H2O(g);△H=b kJmol-1,为①的2倍,所以2a=b,又因为燃烧是放热反应,所以△H<0,即2a=b<0,故A正确;B项,水从气态变为液态会放热,②比④放出的热量少,又因为放热反应△H<0,所以d<b<0,故B错误;C项,燃烧是放热反应,△H<0,放出的热量越多,值越小,水从气态变为液态会放热,所以c<a<0,故C错误;D项,燃烧是放热反应,△H<0,应为:2c=d<0,故D错误。
molO2完全反应生成1mol气态H2O时放出a kJ热量,物质的量与热量成正比例关系,②2H2(g)+O2(g)=2H2O(g);△H=b kJmol-1,为①的2倍,所以2a=b,又因为燃烧是放热反应,所以△H<0,即2a=b<0,故A正确;B项,水从气态变为液态会放热,②比④放出的热量少,又因为放热反应△H<0,所以d<b<0,故B错误;C项,燃烧是放热反应,△H<0,放出的热量越多,值越小,水从气态变为液态会放热,所以c<a<0,故C错误;D项,燃烧是放热反应,△H<0,应为:2c=d<0,故D错误。


科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于放热反应的是()
A.氢氧化钠与稀盐酸的反应B.甲烷在氧气中的燃烧反应
C.灼热的碳与CO2的反应D.Ba(OH)28H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境密切相关,下列有关说法正确的是
A. CO2属于大气污染物
B. 酸雨是pH小于7的雨水
C. CO2、NO2或SO2都会导致酸雨的形成
D. 大气中CO2含量的增加会导致温室效应加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A. 2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C. CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D. FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于焊接钢轨,F与D同主族,F与G同周期。
(1)D、E、F 的离子半径由大到小的顺序为_________(填离子符号)。
(2)写出能证明G比F非金属性强的一个离子方程式_____________。
(3)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2:1:6,甲的电子式为_______,该反应的化学方程式为___________________。
(4)C能分别与A和D按原子个数比1:2形成化合物乙和丙,乙的结构式为_______。常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QkJ,该反应的热化学方程式为_____________________。
(5)现取100mL 1mol/L的E的氯化物溶液,向其中加入1mol/L 氢氧化钠溶液产生了3.9g沉淀,则加入的氢氧化钠溶液体积可能为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法正确的是
①用蒸馏法分离乙醇和水的混合物②用过滤的方法分离二氧化锰和碳酸钙
③用乙醇萃取碘水中的碘:④用蒸发溶剂的方法可以从氯化钠溶液中得到氯化钠的晶体
A. ①和② B. ②和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有毒气体的减排和处理是工业生产中的重要课题。
(1)Na2CO3溶液可吸收尾气SO2,反应过程中溶液组成变化如下图。

①SO2分子属于________ (选填“极性”或“非极性”) 分子,以上反应_____(选填“能”或“不能”) 说明S、C两种元素的非金属性强弱。
②A点反应的离子方程式是_____。
(2)汽车发动机稀燃控制系统主要工作原理是发动机在稀燃和富燃条件下交替进行,尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:

①已知Ba(NO3)2分解产物含有两种气体,由上图信息,写出Ba(NO3)2分解反应的化学方程式_______。
②下列说法正确的是__________
A.稀燃过程的目的是固氮
B.在整个过程中,Pt和BaO都可看作催化剂
C.汽车尾气若不处理,其中的氮氧化物等可能形成光化学烟雾
D.富燃过程中,NO2与CO反应,氧化产物和还原产物的物质的量之比为1:1
③实验测出,每千克CxHy (以液体C8H18为例) 在O2中充分燃烧生成液态水,放出4.78×104kJ热量。写出C8H18燃烧热的热化学反应方程式______________。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+ H2O =2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①下图是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为_______%。
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=5 :3时,可通入一定量的空气,同温同压下,V(空气): V(NO)=___________ (空气中氧气的体积含量大约为20%)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制药厂尾气中含少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境。分别用0.1 mol·L-1的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是( )
A.NaOH溶液的体积大于氨水
B.NaOH溶液的体积等于氨水
C.NaOH溶液的体积小于氨水
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示: 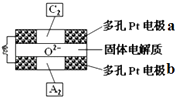
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置 .
(2)化合物乙的电子式为 , 用电子式表示形成化合物丁的过程
(3)写出丙与甲反应的离子方程式: .
(4)固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许O2﹣在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体.该电池的负极为(填a或b);O2﹣流向极(填“正”或“负”);该电池的正极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com