
【题目】在理论上可用于设计原电池的化学反应是 ( )
A. 2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C. CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D. FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
科目:高中化学 来源: 题型:
【题目】下列反应不可能作为原电池工作时发生的反应的是( )
A. Cu+2AgNO3=Cu(NO3)2+2Ag
B. 2Fe+O2+2H2O=2Fe(OH)2
C. 2H2+O2=2H2O
D. NaOH+HCl=NaCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、﹣3 | +7、﹣1 | +5、﹣3 | ﹣2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族);
(2)8个元素的最高价氧化物的水化物中,酸性最强的是(填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为 , 稳定性最强的氢化物的结构式为;
(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式;
(5)用电子式表示元素①与⑥形成化合物的过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按图所示的装置进行电解实验。下列说法正确的是( )
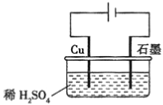
A. 电解过程中,铜极上有H2生成
B. 电解初期,主反应方程式为:2H2O=H2↑+O2↑
C. 整个电解过程中,H+的浓度不断增大
D. 电解一定时间后,石墨电极上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的物质的量为_______mol,NO2的物质的量为________mol。
(2)待产生的气体全部释放后,向溶液加入VmL、amolL-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为_______mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中企部转化为NaNO3,至少需耍30%的双氧水______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A. 2a=b<0 B. b>d>0 C. a<c<0 D 2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断段化学反应速率最快,段收集的氢气最多. 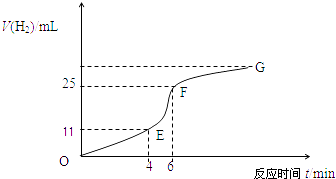
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 , 一定时间后反应速率逐渐减慢,其原因是 .
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
E.降低温度
(4)EF段产生H2的反应速率为mLmin﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:CH3CH2OH+NaBr+H2SO4(浓) ![]() CH3CH2Br+NaHSO4 +H2O。实验室制备溴乙烷(沸点为38.4℃) 的装置如图: 圆底烧瓶中加入10mL 95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
CH3CH2Br+NaHSO4 +H2O。实验室制备溴乙烷(沸点为38.4℃) 的装置如图: 圆底烧瓶中加入10mL 95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
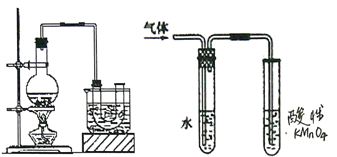
(1)反应时若温度过高会降低溴乙烷的产率,原因是______;也可看到有红棕色气体产生,该气体的化学式为_________。为避免温度过高,宜采用_________加热。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去其中的杂质,最好选用下列试剂中的_______(填序号)。
A.Na2SO3溶液B.H2OC.NaOH溶液D.CCl4
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用上面右图所示装置进行实验:该实验的目的是________。盛水的试管(装置)的作用是____。
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后______(填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为______ (保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com