
【题目】某科研课题小组研究利用含H+、Zn2+、Mn2+、Fe2+、Fe3+、Cl-、SO42-的工业废液,制备高纯的ZnO、MnO2、Fe2O3,设计出如下实验流程:

已知:
①氢氧化锌沉淀呈白色
②氢氧化锰难溶于水
③溶液中金属离子沉淀完全时,其浓度![]()
回答下列问题:
(1)向工业废液中加入双氧水,可能观察到的现象有:溶液的颜色发生变化和_____,其中引起溶液颜色变化的离子方程式为_____。
(2)第一次调pH的目的是沉淀Fe3+。 检验Fe3+是否完全沉淀的操作:取少量滤液于洁净试管中,最好加入下列试剂中的____ (填标号),并观察实验现象。
a.稀氨水 b.KSCN溶液 c.K3Fe(CN)6溶液
(3)第二次调pH前,科研小组成员在室温下分析此时的溶液,得到相关数据见下表

为防止Mn2+也同时沉淀造成产品不纯,最终选择将溶液的pH控制为7.5,则此时溶液中Zn2+ 的沉淀率为____ 。 (第二次调pH前后液体体积的变化忽略不计)
(4)已知常温下,![]() 。在除锌时发生沉淀转化反应为
。在除锌时发生沉淀转化反应为![]() ,其平衡常数K= ___。
,其平衡常数K= ___。
(5)沉锰反应在酸性条件下完成,写出反应的离子方程式____。
(6)下列关于沉锰制备高纯MnO2的说法中,不正确的是____ (填标号)。
a.若沉锰反应时加入足量浓盐酸并加热,MnO2的产率将降低
b.若沉锰后进行过滤操作,为了加快过滤速率,不断用玻璃棒搅拌
c.若除锌时加入MnS质量为xg,沉锰反应中锰元素无损失,MnO2的产量将增加xg
【答案】有无色气体生成 2Fe2++H2O2+2H+=2Fe3++2H2O b 99.9% 2.0×1010 Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+ bc
【解析】
含H+、Zn2+、Mn2+、Fe2+、Fe3+、Cl-、SO42-的工业废电解质溶液,加入双氧水将Fe2+氧化为Fe3+,加入NaOH溶液调节pH沉淀Fe3+得到Fe(OH)3,过滤,向滤液中再次加入NaOH溶液调节pH,将Zn2+沉淀为Zn(OH)2,所以滤渣II主要为Zn(OH)2,向滤液中加入MnS除去剩余锌,过滤掉生成的ZnS,向滤液中加入Na2S2O8,发生反应:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+,据此分析作答。
(1)向工业废液中加入双氧水,亚铁离子被氧化成铁离子,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;所以溶液颜色会发生变化,同时溶液中的金属阳离子会催化双氧水的分解生成氧气,所以会观察到有无色气体生成;
(2)检验Fe3+常用KSCN溶液,若有铁离子溶液会变红色,加稀氨水溶液中的Zn2+、Mn2+也会生成沉淀,可能观察不到红褐色沉淀,K3Fe(CN)6溶液可用来检验Fe2+,所以选b;
(3)pH=7.5时,溶液中c(OH-)=10-6.5mol/L,根据Ksp[Zn(OH)2]= c2(OH-)·c(Zn2+)=1.2×10-17可知此时溶液中c(Zn2+)= ,所以此时溶液中Zn2+ 的沉淀率为
,所以此时溶液中Zn2+ 的沉淀率为![]() =99.9%;
=99.9%;
(4)根据反应方程式可知该反应的平衡常数K= ;
;
(5)沉锰时Na2S2O8将Mn2+氧化成MnO2,自身被还原成SO42-,根据电子守恒和元素守恒可知离子方程式Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
(6)a.浓盐酸具有还原性,且还原性强于Mn2+,所以先被Na2S2O8氧化,且会与生成的MnO2反应,降低产率,故a正确;
b.玻璃棒搅拌过滤器,易捣碎滤纸,过滤时不能搅拌,故b错误;
c.为保证完全除去锌离子,除锌时加入的MnS要过量,不能完全反应,故c错误;
综上所述选bc。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物说法正确的是( )
A.CH3Cl、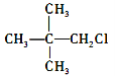 、
、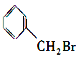 中加入 NaOH 的醇溶液共热,然后加入稀硝酸呈酸性,再滴入 AgNO3 溶液,均有沉淀生成
中加入 NaOH 的醇溶液共热,然后加入稀硝酸呈酸性,再滴入 AgNO3 溶液,均有沉淀生成
B.CH3Cl 中加入 NaOH 的水溶液共热,再滴入 AgNO3溶液,可检验该物质中含有的卤素原子
C.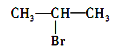 发生消去反应得到两种烯烃
发生消去反应得到两种烯烃
D.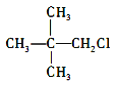 与 NaOH 的水溶液共热,反应后生成的醇能被氧化为醛
与 NaOH 的水溶液共热,反应后生成的醇能被氧化为醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.用排饱和食盐水法收集Cl2
B.加压有利于合成氨反应
C.冰镇的啤酒打开后泛起泡沫
D.对2HI![]() H2+I2(g)平衡体系增加压强使颜色变深
H2+I2(g)平衡体系增加压强使颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所示,下列说法错误的是

A. 反应总过程ΔH<0
B. Fe+使反应的活化能减小
C. FeO+也是该反应的催化剂
D. Fe++N2O![]() FeO++N2、FeO++CO
FeO++N2、FeO++CO![]() Fe++CO2两步反应均为放热反应
Fe++CO2两步反应均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲是利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中错误的是( )

A.乙装置中溶液颜色不变
B.铜电极应与Y相连接
C.M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D.当N电极消耗0.25mol气体时,铜电极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
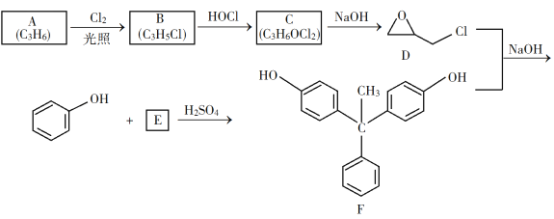

已知以下信息:
①
② ③
③
回答下列问题:
(1)A是一种烯烃,化学名称为__________,C中官能团的名称为_________、_________。
(2)由B生成C的反应类型为_________。
(3)由C生成D的反应方程式为__________________。
(4)E的结构简式为__________________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式__________、_________。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和![]() 恰好完全反应生成
恰好完全反应生成![]() 单一聚合度的G,若生成的
单一聚合度的G,若生成的![]() 和
和![]() 的总质量为
的总质量为![]() ,则G的n值理论上应等于__________。
,则G的n值理论上应等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯分子的说法不正确的是( )
A.苯分子中![]() 原子采用
原子采用![]() 杂化,形成夹角为
杂化,形成夹角为![]() 的三个
的三个![]() 杂化轨道
杂化轨道
B.每个碳原子有一个与碳环平面垂直的未参与杂化的![]() 轨道,以“肩并肩”方式相互重叠,形成大
轨道,以“肩并肩”方式相互重叠,形成大![]() 键
键
C.苯分子中最多有六个原子共面,六个碳碳键完全相同
D.苯分子中的大![]() 键可表示为
键可表示为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com