
【题目】下图表示在没有通风橱时制取纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹。
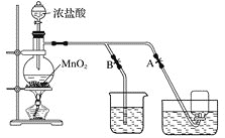
(1)烧杯中盛放的液体是__________,其作用是_________,水槽中盛放的液体是_________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应__________________________;当氯气纯度合乎要求时,应__________________________________,当氯气收集完毕时,应______。
(3)将8.7 g二氧化锰与含氯化氢14.6 g的浓盐酸共热制氯气,甲同学认为可制得氯气 7.1 g,乙同学认为制得氯气的质量小于7.1 g,你认为________(填“甲”或“乙”)同学正确,原因是_________。
【答案】氢氧化钠溶液 吸收多余的氯气 饱和食盐水 打开B夹,关闭A夹 打开A夹,关闭B夹 关闭A夹,打开B夹 乙 ①浓盐酸易挥发;②随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应
【解析】
(1)实验室常用二氧化锰和浓盐酸在加热条件下生成氯气,根据氯气的性质分析解答;
(2)根据氯气的性质判断其收集方法以及尾气处理的方法;
(3)根据反应特点以及稀盐酸和二氧化锰不反应分析解答。
(1)因为氯气有毒,可污染空气,要进行尾气吸收,并且氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以常用氢氧化钠溶液吸收尾气,烧杯中盛放氢氧化钠溶液收;氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气,即水槽中盛放的液体是饱和食盐水;
(2)氯气在饱和氯化钠溶液中的溶解度很小,实验室常用排饱和食盐水法收集氯气,收集时,为得到较为纯净的氯气,应先排除装置内的空气,则应打开B夹,关闭A夹;收集时,应打开A夹,关闭B夹,收集完毕,关闭A夹,打开B夹,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气;
(3)由于浓盐酸易挥发,随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应,所以制得氯气的质量小于7.1 g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
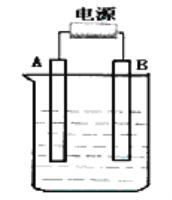
【题目】请用下图所示仪器装罝设计一个电解饱和食盐水,并测定电解产生氢气的 体积和检验氯气氧化性的实验装置。

(1)所选仪器连接时,各接口的顺序是(填各接口的代号字母);a接 , 接 ,b接 , 接 。______________
(2)证明有Cl2生成的实验现象是____________。
(3)实验时,装置中的铁电极接电源的____________极,石墨电极的反应式为____________。
(4)装置E读取气体体积时,应进行的实验操作是____________,若实验结束后装置E的读数(已折算成标准状况)为5.60mL,电解后溶液的体积恰好为50.0mL,则溶液中OH-的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500mL含—种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
(1)写出电解时反应的总离子方程式____________________。
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重6g。电解后溶液的pH为_____________。要使电解后溶液恢复到电解前的状态,则需加入_____________,其质量为_____________g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c (SO42-) =2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__________________________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。

(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O

回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是____________。
(2)装置B的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象____________。
(3)装置C中表现了SO2的____________性;装置D中表现了SO2的____________性,装置D中发生反应的化学方程式为____________。
(4)F装置的作用是____________,漏斗的作用是____________。
(5)E中产生白色沉淀,该白色沉淀的化学成分为____________(填编号,下同),设计实验证明你的判断____________。
A.BaSO3 B.BaSO4 C.BaSO3和BaSO4
(6)工厂煤燃烧产生的烟气若直接排放到空气中,引发的主要环境问题有____________。
A.温室效应 B.酸雨 C.粉尘污染 D.水体富营养化
工业上为实现燃煤脱硫,常通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,与烟气中SO2反应从而将硫固定,其产物可作建筑材料。写出其中将硫固定的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是
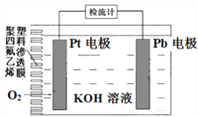
A. Pt电极上发生还原反应
B. 随着使用,电解液的pH逐渐减小
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:

已知:
①![]() ②
②![]()
(1)A的化学名称是___________________。
(2)B的结构简式是_____________,由C生成D的反应类型为_____________________。
(3)化合物E的官能团为__________________________。
(4)F分子中处于同一平面的原子最多有___________个。F生成G的化学反应方程式为_________________________________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2mol NaOH,符合要求的同分异构体有______种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:3:2:1的I结构简式为__________________________。
(6)写出用 为原料制备
为原料制备![]() 的合成路线(其他试剂任选)__________。
的合成路线(其他试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:_________________。
(2)Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______。
②组装该电池必须在无水、无氧的条件下进行,原因是______。
(3)如下图是一个电化学过程示意图

①锌片上发生的电极反应是______。
②假设使用Li﹣SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li﹣SOCl2电池理论上消耗Li的质量______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com