
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:_________________。
(2)Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______。
②组装该电池必须在无水、无氧的条件下进行,原因是______。
(3)如下图是一个电化学过程示意图

①锌片上发生的电极反应是______。
②假设使用Li﹣SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li﹣SOCl2电池理论上消耗Li的质量______g。
【答案】N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol SOCl2+H2O=SO2↑+2HCl↑ 锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应 Cu2++2e-=Cu 28g
【解析】
(1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)①根据SOCl2与NaOH溶液反应的生成物确定SOCl2与水反应的生成物,根据与水反应生成物的性质判断反应现象,从而写出与水反应的方程式;
②根据类比钠的活泼性判断锂的活泼性,根据锂的活泼性以及SOCl2的性质分析;
(3)①锌片连接电源的负极,作阴极,发生还原反应;
②根据同一闭合回路中转移电子数目相等,分析解答。
(1)32.0g肼的物质的量为n(N2H4)=32.0g÷32g/mol=1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol;
(2)①根据NaOH和SOCl2生成Na2SO3和NaCl两种盐可知:SOCl2和水生成酸或酸性氧化物,根据原子守恒得,SOCl2和水生成SO2和HCl,反应方程式为为:SOCl2+H2O=SO2↑+2HCl↑;
②由于锂和钠是同一主族的元素,二者化学性质具有相似性,钠和空气中的氧气、水蒸气反应,因此锂和空气中的氧气、水蒸气也能反应;且SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行;
(3)①根据装置图可知:锌片与外接电源的负极连接,作阴极,发生还原反应,电极反应式为:Cu2++2e-=Cu;
②铜片连接电源的正极,作阳极,发生氧化反应,Cu是+2价的金属,铜片质量变化128g,转移电子的物质的量n(e-)=![]() ×2=4mol,Li是+1价的金属,所以反应消耗Li的质量质量为m(Li)=4mol×7g/mol=28g。
×2=4mol,Li是+1价的金属,所以反应消耗Li的质量质量为m(Li)=4mol×7g/mol=28g。


科目:高中化学 来源: 题型:
【题目】下图表示在没有通风橱时制取纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹。
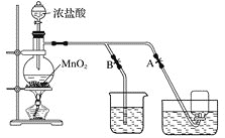
(1)烧杯中盛放的液体是__________,其作用是_________,水槽中盛放的液体是_________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应__________________________;当氯气纯度合乎要求时,应__________________________________,当氯气收集完毕时,应______。
(3)将8.7 g二氧化锰与含氯化氢14.6 g的浓盐酸共热制氯气,甲同学认为可制得氯气 7.1 g,乙同学认为制得氯气的质量小于7.1 g,你认为________(填“甲”或“乙”)同学正确,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀氨水中存在下述电离平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
c(OH-)的变化 | |||
平衡移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质![]() 有下图所示转化关系(部分反应物、生成物未列出)。其中
有下图所示转化关系(部分反应物、生成物未列出)。其中![]() 为某金属矿的主要成分,经过一系列反应可得到气体
为某金属矿的主要成分,经过一系列反应可得到气体![]() 和固体
和固体![]() 。单质
。单质![]() 可与
可与![]() 的浓溶液发生反应,
的浓溶液发生反应,![]() 为砖红色沉淀。
为砖红色沉淀。

请回答下列问题:
(1)写出下列物质的化学式:![]() ______、
______、![]() ______。
______。
(2)反应②的化学方程式是__________________________________________。
(3)利用电解可提纯![]() 物质,现以碱性锌锰电池为外电源,在该电解反应中电解质溶液是_________,阳极物质是____________。
物质,现以碱性锌锰电池为外电源,在该电解反应中电解质溶液是_________,阳极物质是____________。![]() 是碱性锌锰电池的正极材料,电池放电时,正极的电极反应式为________。
是碱性锌锰电池的正极材料,电池放电时,正极的电极反应式为________。
(4)将![]() 和
和![]() 充入一个固定容积为
充入一个固定容积为![]() 的密闭容器中, 在一定温度并有催化剂存在下,进行反应①,经半分钟后达到平衡,测得容器中含
的密闭容器中, 在一定温度并有催化剂存在下,进行反应①,经半分钟后达到平衡,测得容器中含![]() ,则
,则![]() ____________
____________![]() ;若温度不变,继续通入
;若温度不变,继续通入![]() 和
和![]() ,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______
,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______![]() ______
______![]() 。
。
(5)写出![]() 转化过程中,甲醛参与反应的化学方程式: ____________。
转化过程中,甲醛参与反应的化学方程式: ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
 (CH2=CHCOOCH2CH3)
(CH2=CHCOOCH2CH3)
根据以上材料和你所学的化学知识回答下列问题:
(1)由CH2=CH2制得有机物A的化学方程式为______________________________________,反应类型是_____________________。
(2)检验丙烯(CH3CH=CH2)中含有的碳碳双键的化学试剂是____________________。
(3)A与B合成丙烯酸乙酯的化学方程式是______________________________________。该反应的类型是________。
(4)由石油裂解产物乙烯合成聚乙烯塑料的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求,用化学语言回答问题。
(I)除去下列括号内的杂质通常采用的实验方法是什么?将答案填在横线上。
(1)CH3CH2OH(H2O)_____________________________________________________;
(2)![]() (NaCl)____________________________________________;
(NaCl)____________________________________________;
(3) ![]() (Br2)___________________________________________________。
(Br2)___________________________________________________。
(II)某有机物的实验式为C2H6O,用质谱仪测定其相对分子质量,经测定得到如图1所示的质谱图;最后用核磁共振仪处理该有机物,得到如图2所示的核磁共振氢谱图。

试回答下列问题:
(1)该有机化合物的相对分子质量为________。
(2)请写出该有机化合物的结构简式________。
(III)有机物E(C3H3Cl3)是一种播前除草剂的前体,其合成路线如下。

已知D在反应⑤中所生成的E,其结构只有一种可能,E分子中有3种不同类型的氯(不考虑空间异构)。试回答下列问题:
(1)利用题干中的信息推测烃A的结构简式为______________。烃A的同系物中,相对分子质量最小的烃发生加聚反应的化学方程式为____________________________。
(2)写出下列反应的类型:反应①是____________,反应③是________。
(3)利用题干中的信息推测有机物D的名称是______________。
(4)试写出反应③的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是

A. 分子式为:C14H18N2O5
B. 阿斯巴甜分子中有3种官能团
C. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
D. 阿斯巴甜的水解产物中有两种氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol氨基甲酸铵(![]() )置于密闭容器中(容器体积不变,固体试样体积忽略不计)。在一定温度下使其分解达到平衡:
)置于密闭容器中(容器体积不变,固体试样体积忽略不计)。在一定温度下使其分解达到平衡:![]() ,下列能说明该化学反应达到平衡状态的是
,下列能说明该化学反应达到平衡状态的是
A.正、逆反应速率都为零
B.体系压强保持不变
C.![]()
D.![]() 的体积分数保持不变
的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com