
【题目】物质![]() 有下图所示转化关系(部分反应物、生成物未列出)。其中
有下图所示转化关系(部分反应物、生成物未列出)。其中![]() 为某金属矿的主要成分,经过一系列反应可得到气体
为某金属矿的主要成分,经过一系列反应可得到气体![]() 和固体
和固体![]() 。单质
。单质![]() 可与
可与![]() 的浓溶液发生反应,
的浓溶液发生反应,![]() 为砖红色沉淀。
为砖红色沉淀。

请回答下列问题:
(1)写出下列物质的化学式:![]() ______、
______、![]() ______。
______。
(2)反应②的化学方程式是__________________________________________。
(3)利用电解可提纯![]() 物质,现以碱性锌锰电池为外电源,在该电解反应中电解质溶液是_________,阳极物质是____________。
物质,现以碱性锌锰电池为外电源,在该电解反应中电解质溶液是_________,阳极物质是____________。![]() 是碱性锌锰电池的正极材料,电池放电时,正极的电极反应式为________。
是碱性锌锰电池的正极材料,电池放电时,正极的电极反应式为________。
(4)将![]() 和
和![]() 充入一个固定容积为
充入一个固定容积为![]() 的密闭容器中, 在一定温度并有催化剂存在下,进行反应①,经半分钟后达到平衡,测得容器中含
的密闭容器中, 在一定温度并有催化剂存在下,进行反应①,经半分钟后达到平衡,测得容器中含![]() ,则
,则![]() ____________
____________![]() ;若温度不变,继续通入
;若温度不变,继续通入![]() 和
和![]() ,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______
,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______![]() ______
______![]() 。
。
(5)写出![]() 转化过程中,甲醛参与反应的化学方程式: ____________。
转化过程中,甲醛参与反应的化学方程式: ____________。
【答案】(1)SO2Cu2O
(2)Cu+2H2SO4浓)![]() SO2↑+ CuSO4+2H2O
SO2↑+ CuSO4+2H2O
(3)CuSO4溶液 粗铜 MnO2+ H2O+e-=MnOOH+OH-
(4)0.036 ; 正反应方向 ; 0.36 ;0.40;
(5)HCHO+2CuOH)2+NaOH![]() HCOONa+Cu2O+3H2O ↓
HCOONa+Cu2O+3H2O ↓
或HCHO+4CuOH)2+2NaOH![]() Na2CO3+2Cu2O+6H2O ↓
Na2CO3+2Cu2O+6H2O ↓
【解析】
试题F与甲醛溶液反应生成G,G为砖红色沉淀,则G为Cu2O; A为某金属矿的主要成分,则A中含有Cu元素,经过一系列反应可得到气体B和固体C。单质C可与E的浓溶液发生反应,判断C为Cu单质,则E为酸,B能与氧气反应生成C,C能与水反应生成相应的酸,所以B是二氧化硫,C是三氧化硫,E为硫酸,Cu与浓硫酸加热反应生成二氧化硫和硫酸铜,硫酸铜与氢氧化钠溶液、甲醛反应生成氧化亚铜沉淀,符合此图。
(1)根据以上分析,B的化学式是SO2;G为Cu2O;
(2)反应②为Cu与浓硫酸的反应,化学方程式为Cu+2H2SO4浓)![]() SO2↑+ CuSO4+2H2O;
SO2↑+ CuSO4+2H2O;
(3)提纯Cu时,用粗铜作阳极,纯铜作阴极,硫酸铜作电解质溶液,则铜离子在阴极析出,从而提纯Cu;MnO2是碱性锌锰电池的正极材料,电池放电时,正极发生还原反应,Mn元素的化合价降低,与水结合生成碱式氧化锰和氢氧根离子,电极反应式为MnO2+ H2O+e-=MnOOH+OH-;
(4)二氧化硫与氧气的反应方程式是2SO2+O2![]() 2SO3,经半分钟后达到平衡,测得容器中含三氧化硫0.18 mol,说明消耗氧气的物质的量是0.09mol,则vO(2)="0.09mol/5L/0.5min=0.036" mol/L·min);继续通入0.20 mol B和0.10 mol O2,相当于反应物浓度增大,缩小容器体积,压强增大,平衡正向移动,再达平衡时,三氧化硫的物质的量比原来的2倍还多,所以大于0.36mol,容器中相当于有0.4mol二氧化硫,可逆反应不会进行到底,所以三氧化硫的物质的量小于0.40mol;
2SO3,经半分钟后达到平衡,测得容器中含三氧化硫0.18 mol,说明消耗氧气的物质的量是0.09mol,则vO(2)="0.09mol/5L/0.5min=0.036" mol/L·min);继续通入0.20 mol B和0.10 mol O2,相当于反应物浓度增大,缩小容器体积,压强增大,平衡正向移动,再达平衡时,三氧化硫的物质的量比原来的2倍还多,所以大于0.36mol,容器中相当于有0.4mol二氧化硫,可逆反应不会进行到底,所以三氧化硫的物质的量小于0.40mol;
(5)F是硫酸铜,先与氢氧化钠溶液反应生成氢氧化铜,甲醛与氢氧化铜发生氧化反应,生成氧化亚铜砖红色沉淀,化学方程式是HCHO+2CuOH)2+NaOH![]() HCOONa+Cu2O+3H2O ↓
HCOONa+Cu2O+3H2O ↓
或HCHO+4CuOH)2+2NaOH![]() Na2CO3+2Cu2O+6H2O ↓。
Na2CO3+2Cu2O+6H2O ↓。


科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500mL含—种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
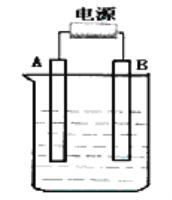
(1)写出电解时反应的总离子方程式____________________。
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重6g。电解后溶液的pH为_____________。要使电解后溶液恢复到电解前的状态,则需加入_____________,其质量为_____________g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c (SO42-) =2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:

已知:
①![]() ②
②![]()
(1)A的化学名称是___________________。
(2)B的结构简式是_____________,由C生成D的反应类型为_____________________。
(3)化合物E的官能团为__________________________。
(4)F分子中处于同一平面的原子最多有___________个。F生成G的化学反应方程式为_________________________________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2mol NaOH,符合要求的同分异构体有______种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:3:2:1的I结构简式为__________________________。
(6)写出用 为原料制备
为原料制备![]() 的合成路线(其他试剂任选)__________。
的合成路线(其他试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出的相应结论正确的是( )
实验 | 现象 | 结论 |
A.某溶液中滴加 | 产生蓝色沉淀 | 原溶液中有 |
B.①某溶液中加入 ②再加足量盐酸 | ①产生白色沉淀 ②仍有白色沉淀 | 原溶液中有 |
C.向含有 | 生成黑色沉淀 |
|
D.向 | 溶液变浑浊 | 酸性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属的冶炼根据金属的活动性不同,可以采用不同的冶炼方法,以下不是金属冶炼方法的是
A.2HgO![]() 2Hg+O2↑
2Hg+O2↑
B.2NaCl(熔融) ![]() 2Na+Cl2↑
2Na+Cl2↑
C.SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:_________________。
(2)Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______。
②组装该电池必须在无水、无氧的条件下进行,原因是______。
(3)如下图是一个电化学过程示意图

①锌片上发生的电极反应是______。
②假设使用Li﹣SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li﹣SOCl2电池理论上消耗Li的质量______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO 4 溶液中 Fe+Cu 2+ =Cu+Fe 2+ | 将Na加入到CuSO 4 溶液中 2Na+Cu 2+ =Cu+2Na + |
B | 铁和氯气反应2Fe+3Cl 2 | 镁和氯气反应Mg + Cl 2 |
C | 稀硫酸与NaOH溶液反应至中性 H + +OH - =H 2 O | 稀硫酸与Ba(OH)2溶液反应至中性 H + +OH - =H 2 O |
D | 向AlCl 3溶液中加入过量NaOH溶液 Al3+ +4OH- = AlO2- +2H2O | 向AlCl 3溶液中加入过量氨水 Al3+ +4OH- = AlO2- +2H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com