
【题目】将1mol氨基甲酸铵(![]() )置于密闭容器中(容器体积不变,固体试样体积忽略不计)。在一定温度下使其分解达到平衡:
)置于密闭容器中(容器体积不变,固体试样体积忽略不计)。在一定温度下使其分解达到平衡:![]() ,下列能说明该化学反应达到平衡状态的是
,下列能说明该化学反应达到平衡状态的是
A.正、逆反应速率都为零
B.体系压强保持不变
C.![]()
D.![]() 的体积分数保持不变
的体积分数保持不变
【答案】B
【解析】
A.化学平衡是动态平衡,平衡时正逆反应速率相等,但不为0,故A不选;
B.在温度和容器的容积固定不变时,体系压强和气体的物质的量成正比。随着反应的进行,气体物质的量逐渐增大,所以压强逐渐增大,当压强保持不变时,说明反应达到了平衡状态,故B选;
C.由于起始加入的是氨基甲酸铵,其分解生成的NH3和CO2的物质的量之比为2:1,所以NH3和CO2的浓度比一直保持2:1,故当![]() 时,不能说明反应达到平衡状态,故C不选;
时,不能说明反应达到平衡状态,故C不选;
D.由于起始加入的是氨基甲酸铵,其分解生成的NH3和CO2的物质的量之比为2:1,![]() 的体积分数一直为
的体积分数一直为![]() ,所以
,所以![]() 的体积分数保持不变不能说明反应达到平衡状态,故D不选;
的体积分数保持不变不能说明反应达到平衡状态,故D不选;
故选B。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:

已知:
①![]() ②
②![]()
(1)A的化学名称是___________________。
(2)B的结构简式是_____________,由C生成D的反应类型为_____________________。
(3)化合物E的官能团为__________________________。
(4)F分子中处于同一平面的原子最多有___________个。F生成G的化学反应方程式为_________________________________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2mol NaOH,符合要求的同分异构体有______种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:3:2:1的I结构简式为__________________________。
(6)写出用 为原料制备
为原料制备![]() 的合成路线(其他试剂任选)__________。
的合成路线(其他试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:_________________。
(2)Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______。
②组装该电池必须在无水、无氧的条件下进行,原因是______。
(3)如下图是一个电化学过程示意图

①锌片上发生的电极反应是______。
②假设使用Li﹣SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li﹣SOCl2电池理论上消耗Li的质量______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO 4 溶液中 Fe+Cu 2+ =Cu+Fe 2+ | 将Na加入到CuSO 4 溶液中 2Na+Cu 2+ =Cu+2Na + |
B | 铁和氯气反应2Fe+3Cl 2 | 镁和氯气反应Mg + Cl 2 |
C | 稀硫酸与NaOH溶液反应至中性 H + +OH - =H 2 O | 稀硫酸与Ba(OH)2溶液反应至中性 H + +OH - =H 2 O |
D | 向AlCl 3溶液中加入过量NaOH溶液 Al3+ +4OH- = AlO2- +2H2O | 向AlCl 3溶液中加入过量氨水 Al3+ +4OH- = AlO2- +2H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
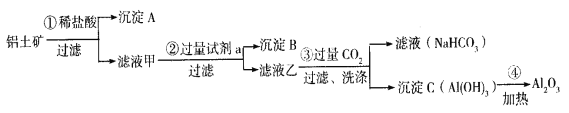
①沉淀 A、B的成分分别是____________、____________;步骤②中的试剂a是_________;(以上均填化学式)。
②试写出步骤③中发生反应的离子方式______________、________________;
③简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①氧化剂最好选用__________(填编号)。
A.KMnO4 B.HNO3 C.Cl2
②写出“酸溶”时主要的离子方程式__________________________
③从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)。
A. 过滤 B. 蒸发至干 C. 冷却结晶 D. 蒸发浓缩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由实验得出的结论正确的是( )
选项 | 实验操作及现象 | 结论 |
A | 甲烷与氯气以体枳比1:1混合在光照下反应生成油状物质 | 油状物质为一氯甲烷 |
B | 将苯加入溴水中,振荡,溴水层为无色 | 苯与Br2发生了加成反应 |
C | 碳酸钠溶液中加入乙酸产生气泡 | 乙酸酸性强于碳酸 |
D | 加热乙醇、冰醋酸及浓硫酸的混合液,有果香味物质生成 | 乙醇与冰醋酸发生了加成反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产纯碱的工艺流程示意图如下:
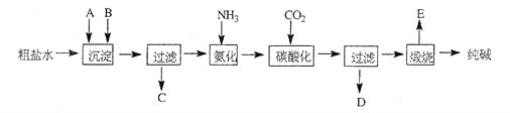
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A于石灰窑厂),写出A、B的化学式;A_______B_______
(2)实验室提纯粗盐的实验操作依次为:_______
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_______。碳酸化时没有析出碳酸钠晶体,其原因是_______。
(4)碳酸化后过滤,滤液D最主要的成分是_______ (填写化学式),检验这一成分的阴离子的具体方法是_______:。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:_______,滤液D加石灰水前先要加热,原因是_______。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:_______ (注明你的表达式中所用的有关符号的含义)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,![]() 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com