
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。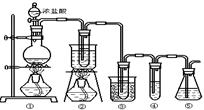
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH溶液.并置于热水浴中;③的试管里盛有15mL 8%NaOH溶液.并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为___色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为___色 | _________________________________________ |
(l)分液漏斗(1分); B (1分)
(2)碱溶液(或反应物)的浓度不同,反应温度不同(2分); M(1分);过滤 (1分)
(3)Cl2 + 2OH-=ClO- + Cl一+H2O (2分)
(4)红(1分) 氯气与水反应生成的HClO将石蕊氧化为无色物质(1分) 黄绿(1分) 继续通入的氯气溶于水使溶液呈黄绿色(1分)
解析试题分析:(1)第一空考查仪器的识别,为分液漏斗;用饱和食盐水除去氯气中的氯化氢气体,故在①与②之间安装盛有饱和食盐水的洗气瓶,答案为:B(2)根据题中信息可知,在加热条件下,氯气与30%KOH溶液反应生成氯酸钾,在冰水冷却的条件下,氯气与8 % NaOH溶液反应生成次氯酸钠,两个反应碱溶液(或反应物)的浓度不同,反应温度不同;反应完毕经冷却后,②的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,只有M符合,固体与液体的分离常采用过滤的方法,答案为:碱溶液(或反应物)的浓度不同,反应温度不同; M;过滤;(3)③试管中为制备次氯酸钠,氯气与氢氧化钠反应速率氯化钠与次氯酸钠、水,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O;(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,继续通入氯气,氯气溶于水使溶液呈黄绿色。
考点:考查化学实验,涉及对装置的分析评价、物质的分离提纯、对实验现象的分析


科目:高中化学 来源: 题型:实验题
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水?约1∶2?,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。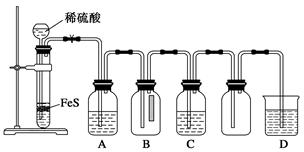
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
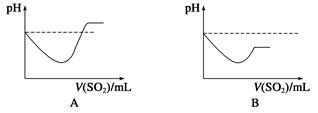
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| | 实验操作 | 实验现象 |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组欲利用下列装置制取少量次氯酸钠,并进一步探究次氯酸钠的化学性质。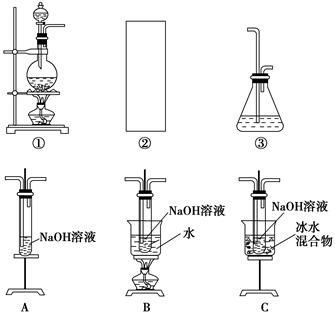
相关资料:反应Cl2+2NaOH=NaClO+NaCl+H2O属于放热反应,温度稍高时便发生副反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O。
(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。请在装置A、B、C中选择一个合适的装置放在②处:____________。
(2)部分学生认为上述装置存在缺点,他们指出在①②装置之间应增加如D所示的装置,你认为D中所盛液体是________,其作用是________________________________________。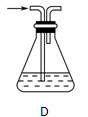
(3)该小组对产品的性质进行了如下探究。
第一步,测其pH=10。结合相关离子方程式解释原因:_________________________________________________________________。
第二步,该小组的同学选用了紫色石蕊试液对次氯酸钠的性质进行探究。请你帮助他们完成下表:
| 实验操作 | 预期现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
如图是某研究性学习小组设计的SO2与Na2O2反应的探究装置.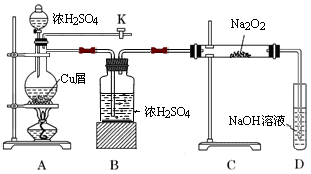
(1)实验开始时,打开旋塞K,通入N2排尽整套装置中的空气,关闭旋塞K。点燃酒精灯,A中反应的化学方程式是 。
(2)B装置的作用是 。
(3)反应过程中,观察到:A中出现黑色不溶物;C中固体由淡黄色逐渐至完全转化为白色;若将带火星木条伸入D试管口内,火星显得更明亮。
①停止加热后,再通入N2至整套装置冷却,其目的是 。
②取少量C中白色固体,溶于蒸馏水得无色溶液W 。若向W中滴加几滴酸性KMnO4溶液,振荡,紫色褪去;若向W中加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀;则说明C中白色固体有 。
③D装置中发生反应的离子方程式是 。
④过滤出A装置中的黑色不溶物,洗涤后将其溶于浓硝酸,得到蓝色溶液并产生红棕色气体;向蓝色溶液中滴加BaCl2溶液,产生白色沉淀;则黑色物质可能是___________。
a.Cu b. CuO c.CuS d.Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。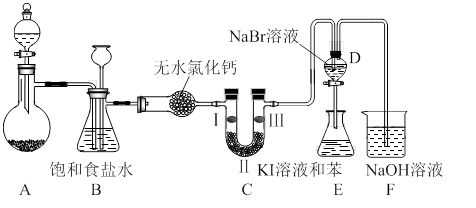
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为: 。
(2)装置B的作用是 ,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。(选a或b或c)
| | a | b | c |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组按下图所示装置进行探究实验。
请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)实验过程中,装置B发生的现象是 ,发生反应的离子方程式为 。
(3)装置C中发生的现象是 ,这说明SO2具有的性质是 。
(4)装置D的目的是探究SO2与品红作用的稳定性,请写出实验操作及现象
。
(5)试设计实验验证装置B溶液是否含有SO42- 。
(6)试在框图内画出SO2尾气处理装置图。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。
(1)装置A中的反应为2KMnO4+16HCl(浓) ="=" 2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是 ,生成71 g Cl2转移的电子是 mol。
装置C中生成SO2,反应的化学方程式是 。
(2)装置B中蘸有NaOH溶液的棉花的作用是 。
(3)打开A、C中分液漏斗的活塞,一段时间后关闭活塞。待反应完全后,小组同学又继续如下实验。
①甲同学取适量B中溶液于试管中,向其中滴加少量AgNO3溶液,有白色沉淀生成。甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了 (填离子符号)。
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个然后再按甲同学的方法即可得到正确结论。
乙同学认为Cl2中混有的杂质是 ,洗气瓶中盛有试剂的名称是 。
③ 丙同学则认为甲、乙两位同学的结论均不合理。丙同学取适量B中溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,则可得出结论,即SO2与Cl2同时通入水中,可以发生反应。溶液X是 (填选项序号)。
A.BaCl2溶液 B.Ba (OH)2溶液 C.Ba (NO3)2溶液 D.品红溶液
SO2与Cl2同时通入水中反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。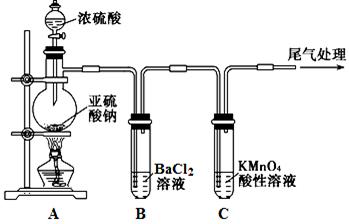
已知:Na2SO3+H2SO4(浓)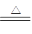 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是 。
(2)实验过程中,C中的现象是 ,说明SO2具有 性。
(3)实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验: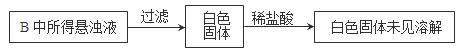
根据实验事实判断该白色沉淀的成分是 (填化学式),产生该白色沉淀的原因可能是 (填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
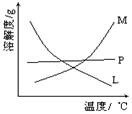
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加
热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠
和另外一种固体。如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至
足量,在滴加稀盐酸的整个过程中 的物质的量浓度变化趋势为 ;
的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加足量盐酸后,烧瓶内除 外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀 ,再加
,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。
(4)写出 固体加热到600℃以上分解的化学方程式 。
固体加热到600℃以上分解的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com